


时间:2019-05-07 10:39 │ 来源: │ 阅读:1391
2019年医疗器械大检查开始全国蔓延!从生产到流通全覆盖,从日常检查、抽查,到重点领域飞检、专项检查全面铺开!
生产、流通、使用全覆盖
飞检和专项检查力度加大
近日,天津市药监局发布《关于印发2019年医疗器械监管工作要点的通知》,制定了2019年医疗器械监管工作要点,明确从生产环节、流通环节开展医疗器械大检查。并且从日常检查、抽查,到重点领域飞检、专项检查全部实施。
文件还明确加大本市生产经营企业飞检力度,特别是加大对高风险企业的检查和有因检查;要做好被检查企业整改复查和风险管控,整改不达标的不能恢复生产,保证企业按规范要求组织生产。
开展违法使用体外诊断试剂和医用成像器械等产品专项检查。重点开展对全市一级以上医疗机构、私立医院、医学美容机构违法违规使用临床检验分析仪器及体外诊断试剂、诊断X射线机、核磁共振成像设备等产品专项检查。
除此之外,在流通领域严厉打击超范围经营,以及无证经营与经营使用无证医疗器械的违法行为。对涉嫌违法犯罪的,及时移送公安机关追究刑事责任。
国家药监局先行
全国多省相继落地,医械大检查来了
早在3月27日,国家药品监督管理局发布《国家药监局综合司关于进一步加强无菌和植入性医疗器械监督检查的通知》,决定从生产、流通和使用三个环节对无菌和植入性医疗器械开展监督检查。
此后,全国范围内多省相继落地!而且检查范围不局限于无菌和植入性医疗器械,而是全医疗器械行业!
4月初,安徽省药监局发布《关于印发全省2019年度药品化妆品医疗器械监督检查工作计划的通知》。紧接着4月23日,黑龙江省药监局发布《全省2019年度医疗器械监督检查工作计划》。
两省检查重点如出一辙!明确从生产环节、流通环节开展医疗器械大检查。并且从日常检查、抽查,到重点领域飞检全部实施。
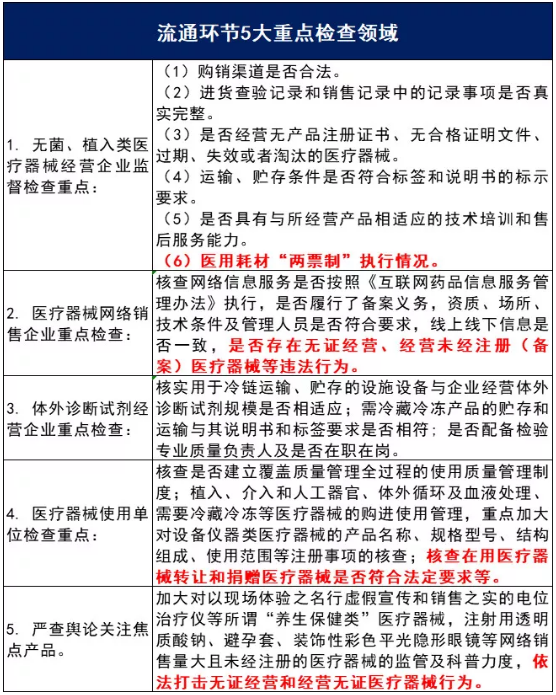
在流通环节,《通知》明确重点强化对提供贮存配送服务类、无菌与植入类、体外诊断试剂类、网络销售类以及质量管理体系差、投诉举报较多、上一年度检查中存在严重问题或受到行政处罚且整改不到位等医疗器械经营企业的监督检查。
并且两省的检查文件中,都重点提到要对医用耗材“两票制”执行情况进行大检查!
4月9日,广东省药品监督管理局启动2019年第一批22家无菌和植入性医疗器械生产企业飞行检查。共派出11组检查队伍,每组均安排有1名国家级检查员(境外检查员)。
飞检企业名单是从全省医疗器械生产企业数据库中随机抽选,检查以组长负责制,检查前不事先告知,检查中发现违法违规行为实施行政处罚,检查结束后全省通报检查结果,并在广东省局网站通报发布飞行检查情况。
在同日,江西省药监局4月9日起,在全省范围组织开展无菌和植入性医疗器械监督检查。此次检查期间,对非法经营关注度高、使用量大的注射用透明质酸钠等产品和利用体验式、会销等营销方式进行超范围经营,以及无证经营和经营无证医疗器械的违法行为,有关部门将依法严肃查处。
4月10日,北京市药监局发布《关于实施2019年药械流通监督检查计划的通知》,明确继续开展打击无证经营与经营无证医疗器械专项整治行动,将经营群众关注度高、应用范围广的注射用透明质酸钠、隐形眼镜、避孕套以及个人自用医疗器械等产品的企业作为检查重点。
另外北京市药监局明确要组织对提供贮存、配送服务业务经营企业、部分经营高风险产品及全市销售额较高的经营企业开展飞检,并且要有计划地对上一年度检查中存在严重问题的、受到行政处罚且整改不到位、投诉举报多、去年专项整治行动中暴露问题较多及实施冷链管理的经营企业实施飞检,提升飞检效能,及时公开飞检查处结果。
其实,无论是抽检还是飞检,都像是一场开卷考试,所有的答案均都已经在开始检查的那一刻,就已成定局,如果企业想做到“来检不惊”、“逢检必过”,那必须在对企业自身质量与管理体系上严格要求,不断提升与突破。
来源丨 法制日报