


时间:2019-10-17 11:27 │ 来源:E药经理人 黄秀芝 │ 阅读:1218
在此次的《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》对参比制剂、处方工艺技术、原辅包质量控制技术、质量研究与控制技术、稳定性研究技术、特殊注射剂一致性评价、改规格注射剂、药品说明书、药品标准、无需开展一致性评价的品种等多个方面明确了相关要求。
这也意味着,备受关注的注射剂一致性评价离医药行业越来越近了。
01、时隔两年终“露面”
注射剂一致性评价一直是行业关注的焦点。从2017年开始,相关文件就在在加紧推进。
2017年12月22日和2018年3月14日,CDE相继发布关于公开征求《已上市化学仿制药(注射剂)一致性评价技术要求》和《药物注射剂研发技术指导意见》建议的通知。
2019年3月28日,CDE发布《化学仿制药参比制剂目录(第二十一批)》,其中包括了224个注射剂参比,涉及88个药品通用名。这是国家层面第一次发布注射剂一致性评价参比制剂信息,此举又引发了业内的一阵热议。
在国内仿制药市场中,注射剂占据了更大的体量,根据中康CMH数据显示,2016年国内注射剂用药规模达7577亿元,化学药注射剂占72%的份额,年销售额在5455亿元左右。因此仿制药注射剂一致性评价在此前就被业内称之为是“将影响医药产业结构”“颠覆医药行业”的重磅政策。
2017 年 10 月,两办发布的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》中提出,“根据药品科学进步情况,对已上市药品注射剂进行再评价,力争用5至10年左右时间基本完成”;
2017年12月,CDE(国家药监局药品评审中心)也发布《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》,不过,因为种种原因,在发布这一版《征求意见稿》之后,化学仿制药注射剂一致性评价一直未有新进展。
★
一般注射剂
与2017版相比内容略有改动。两版征求意见稿均要求从处方、生产工艺等处方工艺角度进行研究和验证,同时对于原料药、辅料、包装等质量控制要求等不同角度进行规范,与国际接轨。2019 版对包材新增要求“注射剂使用的包装材料和容器的质量和性能不得低于参比制剂,以保证药品质量与参比制剂一致”。
特殊注射剂
与 2017 版相比内容未改。
“三改”
2019 版保留“改规格”,删除“改剂型、改盐基”。
整体来看,此次发布的《征求意见稿》中对于国内企业涉及注射剂的的原料药、辅料、包材、灌装等工艺以及改规格、改基团品种都提出了更高的要求。虽然相对于上一版本并无太大差别,但是这将是对于过去注射剂“历史遗留问题”的一次清算,从简单的“仿标准”到对技术、研发水平要求更高的“仿品种”阶段,很多临床安全性差、没有有效性优势、单纯从规格、剂型和盐基等方便做变动而追求特殊地位的药品将逐步退出市场;而对于真正由临床安全性、有效性和质量可控性等改进型仿制药注射剂将脱颖而出。
02、6000亿市场谁将入主
《技术要求》中规定,氯化钠注射液、葡萄糖注射液、葡萄糖氯化钠注射液、注射用水、部分放射性药物(如锝〔99mTc〕)等品种无需开展一致性评价。但同时这也意味着,绝大多数化学仿制药注射剂都要开展一致性评价工作,这对国内注射剂产业带来的影响巨大。米内网数据显示,2018年化药注射剂在国内市场(中国公立医疗机构终端+中国城市零售药店终端)的用药规模达6264.04亿元。
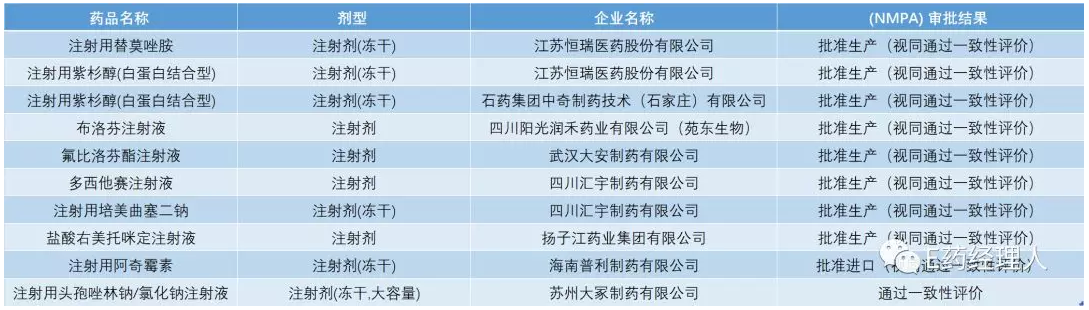 已通过(视同)一致性评价的注射剂
已通过(视同)一致性评价的注射剂
数据来源:医药魔方 国金证券
注射剂一致性评价已呈山雨欲来之势!多数规模较大的口服制剂已有较多企业申报或者已经通过一致性评价,而目前仅有15个注射剂品规、10个品种(视同)通过一致性评价注射剂品种,注射剂的一致性评价将成为未来一段时间仿制药企业竞争的新战场。
截至9月底,CDE承办的注射剂一致性评价补充申请受理号有445个,涉及品种123个;CDE承办的按新注册分类(仿制3类、4类及进口5.2类)申报上市的注射剂受理号有481个,涉及品种192个。
米内网数据显示,目前已有291个注射剂公布参比制剂, 8家药企领跑注射剂一致性评价,科伦、扬子江、正大制药、齐鲁申报注射剂品种数均超30个。有47个注射剂一致性评价申报(一致性评价补充申请及新注册分类申报上市)企业数超过4家(含4家),其中注射用帕瑞昔布钠、盐酸氨溴索注射液、丙泊酚中/长链脂肪乳注射液、盐酸右美托咪定注射液4个品种申报企业数超过10家。
其中,申报企业最多的品种是注射用帕瑞昔布钠,原研辉瑞占据了超过90%的份额。2018年,注射用帕瑞昔布钠在中国公立医疗机构销售额为12.89亿元。目前国内仿制药销量占比最高的是科伦药业,根据科伦药业半年报,上半年科瑞舒(注射用帕瑞昔布钠)销售额约 2.24 亿元,较去年同期增长 692.39%。
自科伦药业公司以首仿资格获批以来,齐鲁、江苏奥赛康、恒瑞、正大天晴、海正先后获批上市,其中恒瑞仅获批40mg规格,其他企业均获批20mg 和40mg 两个规格。从帕瑞昔布一致性评价的进度来看,国内还没有企业通过一致性评价,齐鲁制药、科伦药业、正大天晴、恒瑞医药相对进度较快,已进入审评审批环节。
盐酸氨溴索注射液由14家企业申报,数据显示,盐酸氨溴索注射液在2018年中国公立医疗机构终端的销售额为35.97亿元,同比去年有所下滑,虽然市场缩减,但盐酸氨溴索注射液仍为呼吸系统用药领头产品。目前除了原研药企勃林格殷格翰之外,国内市场已有33家药企)拥有该产品生产批文,此外还有扬子江药业、山东华鲁制药、福安药业等企业的产品还在审评审批中。
从企业方面来看,科伦药业作为大输液龙头企业,在申报注射剂一致性评价方面以76个受理号,46个品种遥遥领先。其中有7个品种首家申报,13个品种独家申报,4个品种暂时未有仿制药获批上市。
扬子江药业紧随其后,以51个受理号、36个品种排在第二位,其中有2个品种首家申报,有7个品种独家申报,有6个品种目前未有仿制药获批上市。其中,盐酸右美托咪定注射液已顺利通过一致性评价,并且在在4+7扩面集采中,扬子江“光脚入场“获得6.7亿的市场。
另外值得关注的是,注射用头孢呋辛钠、注射用盐酸头孢替安、注射用头孢哌酮钠舒巴坦钠、左卡尼汀注射液、注射用头孢噻肟钠等均是年销售额超10亿元的大品种,尚未有企业布局一致性评价。
03、带量采购前站
另一方面,注射剂一致性评价工作的推进也为之后注射剂纳入带量采购进行了铺垫。在9月份刚刚结束的联盟地区药品集中采购中,竞价的25个品种中仅有培美曲塞二钠、盐酸右美托咪定和氟比洛芬酯注射液3种注射剂,中选的5家中标企业的注射剂品种以低降幅甚至零降幅中标,相比口服制剂在带量采购中“血洗”的场面,中标的注射剂企业几乎可以称得上“躺赢”。
而随着注射剂一致性评价的加快推进,未来也会有更多的品种被纳入国家集采。此前,业内预计下一轮全国集采或许年底,最迟明年初开始启动,而下一轮带量采购的内容或许会进一步扩大集采品种范围,此前并未成为主力品种的注射液或将更多的被纳入进来,企业进行注射剂一致性评价的重要性不言而喻。
与此同时,对于像恒瑞医药这样来说,因盐酸右美托咪定此前因未过一致性评价而错失集采机会,无奈将市场“拱手”于扬子江的案例肯定是不想再次出现的。而这次两个文件的发布无疑是利好消息,“独家过评”也将会成为最有力的竞争优势。在此前的启思会上,恒瑞医药董事长孙飘扬曾经表示,将会砍掉部分仿制药品种,而已经递交补充申请和申报上市的共计23个品种,将成为恒瑞接下来的重点突击项目。
在已经通过一致性评价的品种和企业当中,四川汇宇无疑是最大的“赢家”,在此前的带量采购中,汇宇以“黑马”的姿态杀出重围,成为今年最受关注的药企之一,“独家中标”的优势在汇宇这儿得到了最直观的体现。从销售额来看,在去年中国公立医疗机构中销售额最高的是依达拉奉注射液和多西他赛注射液,分别达到了50.26亿元和48.20亿元。而汇宇制药是唯一一家中标多西他赛注射液的企业,如果多西他赛入围下一轮带量采购品种,恒瑞目前近半的市场最大的挑战者无疑将会是汇宇制药。