受此鼓舞,带量采购从11个城市扩展至全国,品种还是那些品种,但规则发生了变化,允许报价最低的3家中选,价格进一步下降。据统计,与第一批试点相比较,平均降幅25%,总采购金额达33.69亿元。而且我们发现,有6家原研企业中标,明显比“4+7”试点时候参与度高。
积累了上述经验后,国家医保局开始进行第二批集采,确定33个品种参与,其中包括他达拉非片、注射用紫杉醇(白蛋白结合型)、安立生坦等非医保品种。其规则也发生巨大变化,N-1家入围后最多允许6家中选,并且制定了最低价1.8倍的熔断机制。
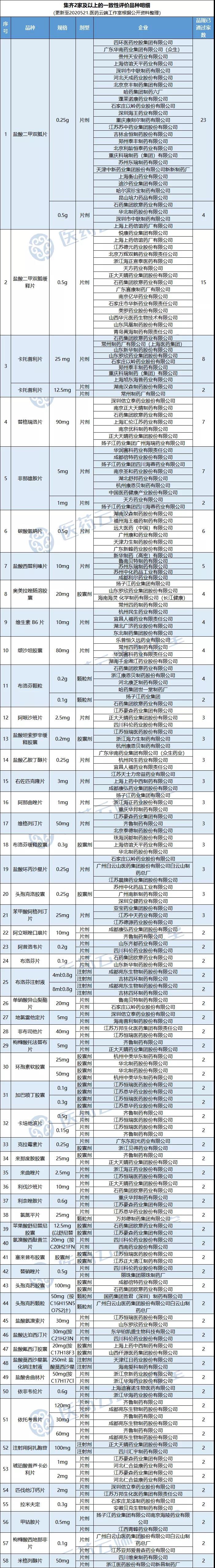
1(原研)+2(2家及以上过评仿制药)组合大概率有效 从前三轮来看,玩法不断更新,药品涉及面也在扩展。不过总体来看前两批集采品种均是处于充分竞争的状态前提下选出的。何为充分竞争?至少是涉及三家生产企业(含原研)。 我们知道国家集采的内在本质是仿制药替代,结合三前轮国采情况,第三批国采很可能会继续沿用三家及以上的竞争模式,也就是1家原研+2家及以上过评模式。 根据医药云端工作室统计,截止目前,已有832个品规通过一致性评价,其中80个品规已有三家或三家以上企业过评。 我们剔除第一批集采的25个品种和第二批集采的33个品种,共有58个品种已有两家及以上企业通过一致性评价。这些都将为第三批国家集采奠定基础。具体如下:
另外一个纳入热点就是注射剂品种。从前三轮来看,注射剂品种数量并不算非常多。由于此前注射剂一致性评价政策一直不明朗,注射剂多数是以按仿制药3类、4类获批上市视同过评的方式获得参与国家集采的资格,比如注射用培美曲塞二钠、盐酸右美托咪定注射液等。 今年5月14日,随着国家药监局官网的发文,注射剂过评终于正式启动。文件明确已上市的化学药品注射剂仿制药,未按照与原研药品质量和疗效一致原则审批的品种均需开展一致性评价。 同时,CDE官网也同步发布了《化学药品注射剂仿制药质量和疗效一致性评价技术要求》、《化学药品注射剂仿制药质量和疗效一致性评价申报资料要求》、《化学药品注射剂(特殊注射剂)仿制药质量和疗效一致性评价技术要求》三份技术文件正式稿。
根据医药云端工作室统计,截止目前仅有33个注射剂品种通过或视同通过一致性评价。我们相信随着政策明朗化后,很多企业必然会扎堆密集的申报,毕竟过评是目前各地挂网的前提条件。目前多个省市已明确过评企业达三家将暂停未过评品种挂网。
据药智网数据显示,截止2020年5月18日,注射剂一致性评价总受理号数达到771个。而随着注射剂过评品种的增多,相信很可能有一批注射剂品种纳入到国家集采中。
新的玩法下,体现了带量采购思路的日益完善,我们认为其核心已经从第一批选取临床常见用量大且过评的品种参与,到只要符合条件的品种达到充分竞争状态(3家及以上)就自动纳入而不再考虑是否是医保药品甚至不考虑市场销量大小。 因此,如果还是这一思路的话,那么不排除有更多的品种将纳入第三批集采,甚至不排除生物类似药进入集采。 近年来生物类似药在国内的发展非常迅猛,从2019年首个生物类似药上市至今,至少已有4个品种获批,并有180家药企在布局该赛道,未来三年内将有近30款生物类似药即将上市。 像目前已经有复宏汉霖的利妥昔单抗(汉利康)上市。此外,“药王”修美乐(阿达木单抗)的生物类似药百奥泰公司及海正药业两家也分别于2019年11月、12月相继获批上市。此前两家企业在江苏挂网价分别为1160元、1150元,低于修美乐(0.8ml:40mg)1290元/支的国谈价格。相信如果一旦纳入集采,势必又是一场价格大战。 安维汀(贝伐珠单抗)的生物类似药已有齐鲁获批上市,信达、恒瑞、绿叶三家药企上市在即。如果这些企业能赶上第三批集采前上市,那或将也是一个国采的热点品种。



