昨日(7月6日),CDE发布《化学药品非处方药上市注册技术指导原则(征求意见稿)》,进一步明确化学药品非处方药上市注册研究要求。该指导原则适用于化学药品类非处方药。
对于药学研究方面,《指导原则》要求OTC质量可控性要求与处方药一致。同时也提出多个药理毒理学研究、临床药理学研究、和临床研究豁免条件,加速药品上市时间。相信随着政策明朗化,部分OTC药品有望快速上市,这对于很多缺乏产品的企业来说,无疑又是一个路子。
此次征求意见的指导原则包括概述、总体考虑、技术要求、附表和附则章节,结合化学药品非处方药的特点,从药学、药理毒理学、临床药理学、临床方面分别阐述了研究与评价的一般原则。
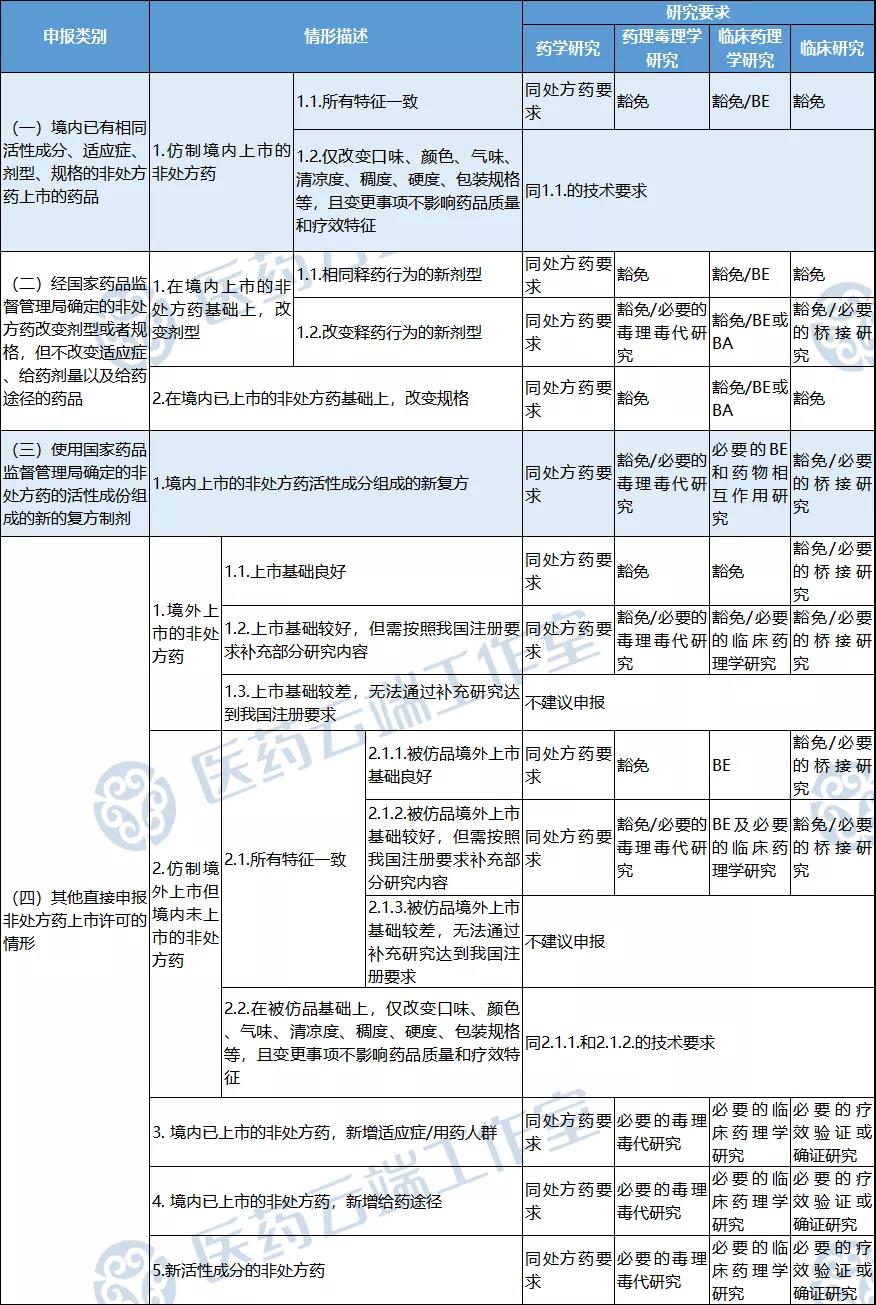
非处方药是指由国家药品监督管理部门批准的,不需要凭执业医师和执业助理医师处方,消费者可以自行判断、购买和使用的药品。非处方药具有有效性明确,安全性范围广,误用和滥用风险低,适应症和用法用量确定,且易于人群自行判断、使用与管理的特点。除此之外,非处方药在剂型、规格、口味、颜色、气味、包装等方面能够更好的满足人群个性化的用药需求。《药品注册管理办法》明确规定,处方药和非处方药实行分类注册和转换管理,符合以下情形之一的,可以直接提出非处方药上市许可申请:(一)境内已有相同活性成分、适应症(或者功能主治) 、剂型、规格的非处方药上市的药品;(二)经国家药品监督管理局确定的非处方药改变剂型或者规格,但不改变适应症(或者功能主治)、给药剂量以及给药途径的药品;(三)使用国家药品监督管理局确定的非处方药的活性成份组成的新的复方制剂;此次制定的《指导原则》也是围绕以上四种情形,基于我国非处方药注册申报特点,制定非处方药上市许可申请的技术要求。
- 认可在已上市的非处方药基础上,结合适应症和品种特点,开发适合我国人群喜好及用药习惯且质量可控的非处方药品种。
符合条件的,可豁免临床研究等,加快上市速度
药学研究:
对于非处方药的质量可控性要求与处方药一致。对于参比制剂已公示认可的品种,应开展与参比制剂的药学对比研究。对于难以明确参比制剂的非处方药品种,在认可临床价值(临床需求)的前提下,可采用质量提升方式开展仿制药评价。
药理毒理学研究:
对于已有长期广泛人用基础或已有较高质量临床研究证据的非处方药品种,通常不再要求进行临床前药理毒理学研究。如无法提供充分证据支持人体安全性或药效可靠性,应考虑开展适当的临床前药理毒理学研究,提供非临床药效和安全性方面的证据,为后续进入人体试验或人体应用的获益风险评估提供支持。
临床药理学研究:
针对非处方药的仿制开发,遵循与处方药一致的原则,通过适当的研究证明与参比制剂的生物等效性。对于外用局部起效的非处方仿制药,在确保药品质量和局部安全性与参比制剂基本一致的前提下,可以豁免生物等效性研究。对于改剂型或改规格的非处方药品种,需要开展必要的生物等效性或生物利用度比较试验。对于采用已确定的非处方药活性成份组成的新复方,需要考虑开展与单方合用对比的生物等效性研究,以及必要的药物相互作用研究。申报新的非处方药活性成分、改变给药途径或新增适应症(用药人群)的非处方药品种,应开展必要的临床药理学研究,考察其人体药代动力学特征,为可能涉及的剂量或给药方式变化提供支持证据。
临床研究:
对于已有较充分证据支持非处方药途径使用的安全性和有效性的品种,应尽可能利用已获得的数据支持注册,避免不必要的临床研究及简化必要的临床研究。对于已在境外上市的非处方药,需结合其上市批准时间、上市前研究基础、上市后应用情况,综合考虑临床价值(临床需求)及我国上市注册研究要求。对于境外上市基础较好的非处方药,可以参考《接受药品境外临床试验数据的技术指导原则》,符合要求的品种,可以豁免临床研究,或仅开展疗效验证性研究。对于改剂型或改规格的非处方药品种,以及采用已确定的非处方药活性成份组成的新复方,在临床价值(临床需求)明确且不增加安全性风险的前提下,无需证明临床优势。仅改变口味、颜色、气味、清凉度、稠度、硬度、包装规格等,且变更事项不影响药品质量和疗效特征的非处方药仿制品种,除开展仿制所必须的研究之外,无需进行额外临床研究。对于一些在剂型、给药装置、给药操作方法等方面具有特殊性的非处方药品种,应额外提供其是否符合我国人群用药习惯及便利性的相关依据。
附:针对不同申报情形的研究要求