7月21日,备受业界关注的第三批全国集采又有了新进展。
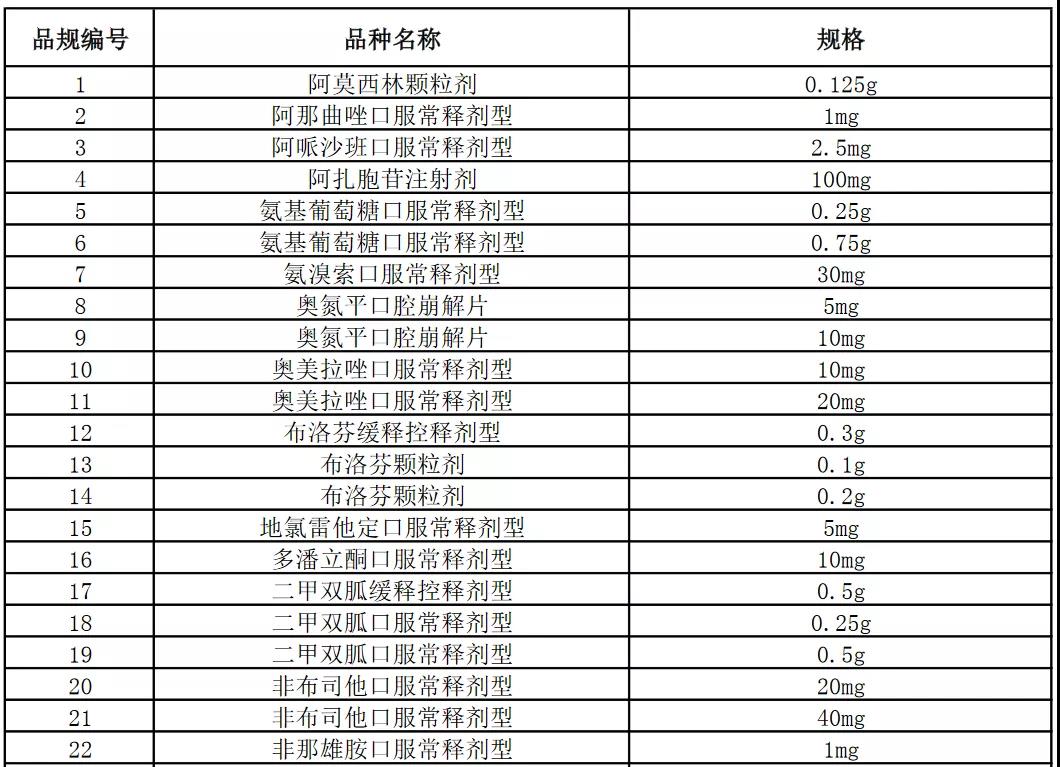
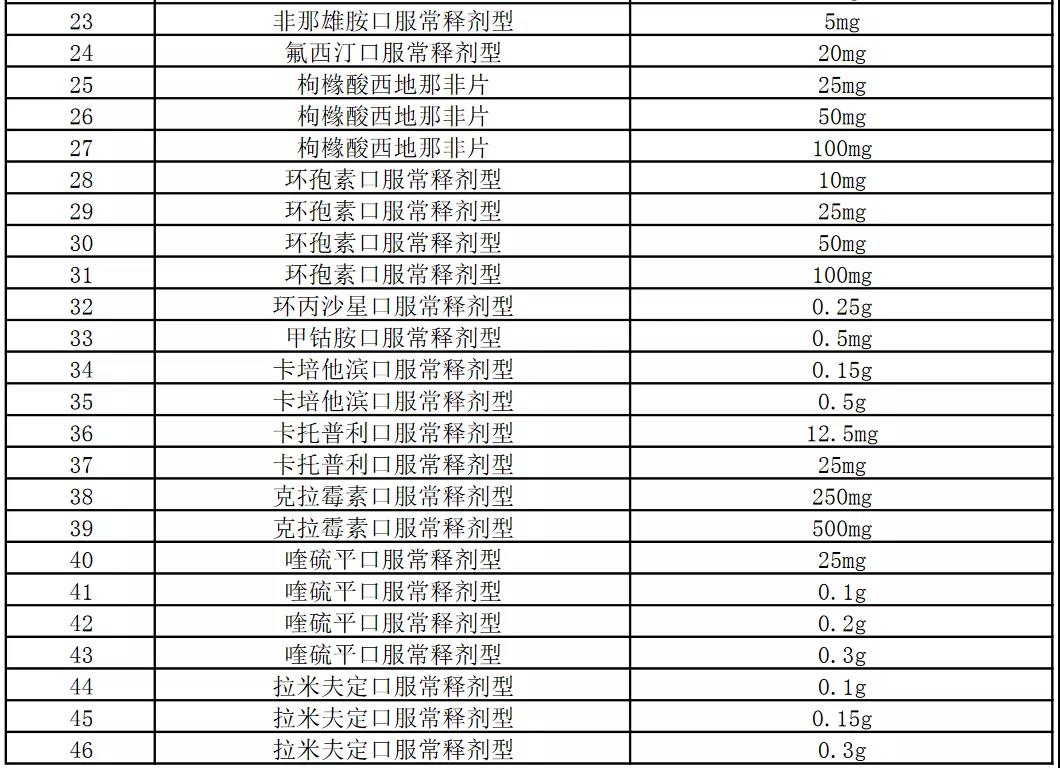
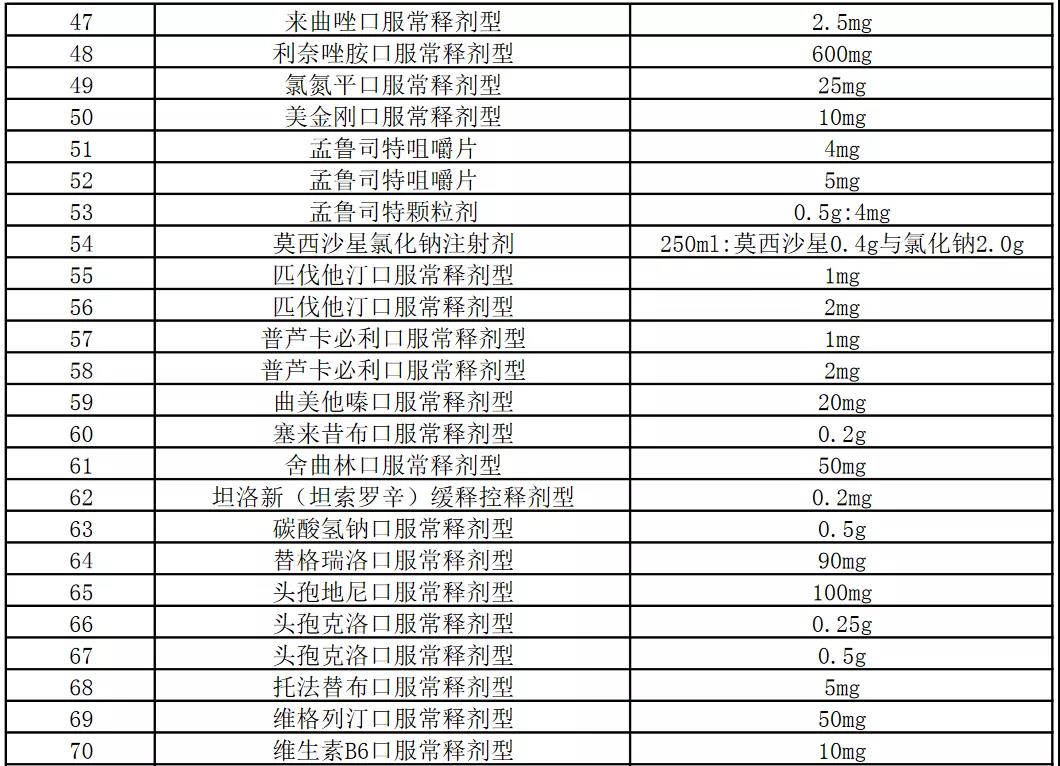
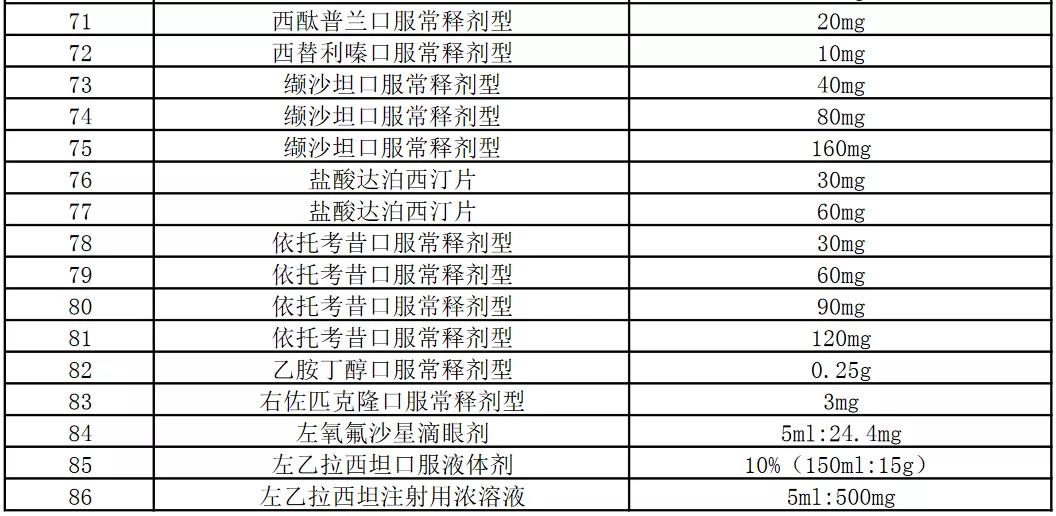
今天,上海阳光医药采购网发布《关于开展部分药品相关基础信息采集工作的通知》,采集86个品规药品相关基础信息:
属于信息采集范围(详见附件)并获得国内有效注册批件的上市药品,且满足以下要求之一:1.原研药及国家药品监督管理局发布的仿制药质量和疗效一致性评价参比制剂。2.通过国家药品监督管理局仿制药质量和疗效一致性评价的仿制药品。3.根据《国家食品药品监督管理总局关于发布化学药品注册分类改革工作方案的公告》〔2016年第51号〕,按化学药品新注册分类批准的仿制药品。属于本次信息采集范围并满足药品要求的相关企业,包括:提供药品及伴随服务的国内药品生产企业,药品上市许可持有人,境外生产企业在中国大陆设立或指定并能承担相应法律责任的代表机构或企业法人。1.生产企业、药品上市许可持有人、境外生产企业在中国大陆设立或指定并能承担相应法律责任的代表机构或企业法人(包括企业名称、统一社会信用代码、联系人、授权书等)。2.符合药品要求的证明材料(包括药品注册批件、补充注册批件、说明书等)。1.本次信息采集工作仅用于相关工作的摸排和研究,不作为药品集中采购企业申报依据,具体申报企业资格及申报品种资格以采购文件规定为准。2.填报方式,请登陆http://pub.smpaa.cn/xxsj/进行企业注册及填报信息。3.联系电话(服务时间8:30-11:30,13:30-16:30):021-31773269、31773279
本次信息采集覆盖52个品种86个品规,包含卡培他滨片、注射用阿扎胞苷、奥氮平口崩片等多个销量大的品种。
其中,还包括在第二批集采中出局的二甲双胍。二甲双胍是临床常用降糖药,通过一致性评价的企业较多,竞争较为激烈。据统计,二甲双胍缓释剂型(0.5g)通过/视同通过一致性评价的企业在17家左右,包括正大天晴、石药欧意、百洋制药等;二甲双胍口服常释剂型(0.5g,0.25g)通过/视同通过一致性评价的企业大约为27家,包括以岭药业、华北制药等。
据悉,第三批国采药品目录的统计、报量工作已于本月中旬完成,正式目录和标书将于月底公布。
附件:信息采集范围