


时间:2020-12-16 17:05 │ 来源:医药云端工作室 │ 阅读:1607
12月14日,国家药监局连发两个通知,批准国内两款自主研发的创新药上市。
江苏恒瑞医药的1类创新药氟唑帕利胶囊(商品名:艾瑞颐),用于既往经过二线及以上化疗的伴有胚系BRCA突变(gBRCAm)的铂敏感复发性卵巢癌、输卵管癌或原发性腹膜癌患者的治疗。
辽宁海思科的1类创新药环泊酚注射液(商品名:思舒宁),用于消化道内镜检查中的镇静。
氟唑帕利为小分子PARP抑制剂,可抑制BRCA1/2功能异常细胞中的DNA修复过程,诱导细胞周期阻滞,进而抑制肿瘤细胞增殖。该品种上市为患者提供了新的治疗选择。
恒瑞医药的氟唑帕利胶囊是国内第 3 个获批上市的 PARP 抑制剂,也是国内企业自主研发的首个 PARP 抑制剂,用于治疗既往经过二线及以上化疗的伴有 BRCA1/2 致病性或疑似致病性突变的复发性卵巢癌患者。
2019年10月29日,恒瑞医药递交氟唑帕利上市申请,同年12月5日,其上市申请被 CDE 纳入优先审评审批中。据恒瑞此前发布的公告显示,截止2019年12月7日,该产品累计已投入研发费用约为2.95亿元。
PARP抑制剂是肿瘤领域新药研发的热门方向,目前全球已有4款PARP抑制剂获批上市,即阿斯利康的奥拉帕利(Olaparib,Lynparza)、Clovis公司的芦卡帕利(Rucaparib,Rubraca)、Tesaro和GSK联合开发的尼拉帕利(Niraparib,Zejula)以及辉瑞的他拉唑帕利(Talazoparib,Talzenna)。
据统计,2019全球PARP抑制剂市场规模已突破16亿美元,其中奥拉帕利是销售额最高,达11.98亿美元。据弗若斯特沙利文报告,预计至2030年,PARP 全球销售额有望突破123亿美元,而中国市场销售额将达44亿元。
目前奥拉帕利和尼拉帕利已在 2018 和 2019 分别在国内获批上市,前者在 2019 年医保谈判中降价 61.8% 进入医保乙类目录,医保支付标准为 169.00 元(150mg/片)。
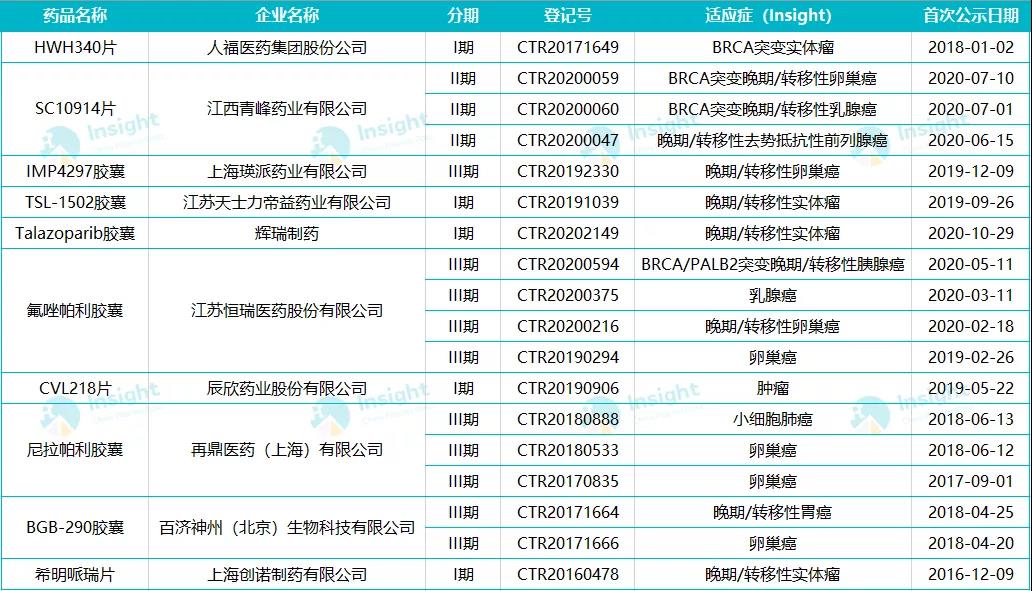
根据 Insight 数据库,恒瑞已针对氟唑帕利开展了 26 项临床,适应症涉及小细胞肺癌、实体瘤、复发转移三阴乳腺癌、前列腺癌、复发性卵巢癌、晚期胃癌等。其中,15 项临床尚在进行中,包括 4 项 III 期临床。
目前,国内已有多个企业布局 PARP 抑制剂,10 个企业已进入临床阶段,具体如下:
环泊酚注射液
根据海思科官网资料,环泊酚(研发代号HSK3486)注射液是海思科历时八年研发的一款具有自主知识产权的静脉麻醉药物,也是该公司的第一个创新药产品。
环泊酚属于短效GABAA受体调节剂,适用于消化道内镜诊断和治疗镇静和/或麻醉。该药是是经典麻醉镇静药丙泊酚的改良型新药,其效能显著高于丙泊酚,且安全性好于丙泊酚。
2019年7月,国家药监局受理了HSK3486乳状注射液用于治疗“消化道内镜诊断和治疗镇静和/或麻醉”适应症的上市申请,以及HSK3486原料药的上市申请。同年8月,HSK3486作为“具有明显治疗优势的创新药”被CDE纳入优先审评。
根据海思科发布的公开数据显示,目前该药品有21项临床研究正在推进,其中13项已完成,8项正在进行。
开展的适应症研究包括消化道内镜检查中的镇静(获批上市)、全身麻醉诱导(NDA申报)、纤维支气管镜诊疗的镇静和/或麻醉(Ⅲ期,已完成)、全身麻醉诱导和维持(Ⅲ期)、ICU镇静(Ⅲ期)等。预计未来每年都会有1-2个适应症获批上市,本次获批上市的是消化道内镜检查中的镇静适应症。
此外在中国申报上市的同时,海思科也布局环泊酚在国际市场的应用。目前,环泊酚已经获得包括美国、欧洲、日本、加拿大等十几个国家和地区的化合物专利证书。同时,公司拟在美国开展临床试验,已于2019年7月31日与美国FDA召开了Pre-IND会议,计划今年底启动美国全麻诱导Ⅲ期临床试验。