


时间:2021-01-07 08:54 │ 来源:医药云端工作室 │ 阅读:4946
我们根据公开资料,梳理筛选出这16个新上市即纳入医保的品种,仅供参考,如有错漏,欢迎留言指正,非常感谢。
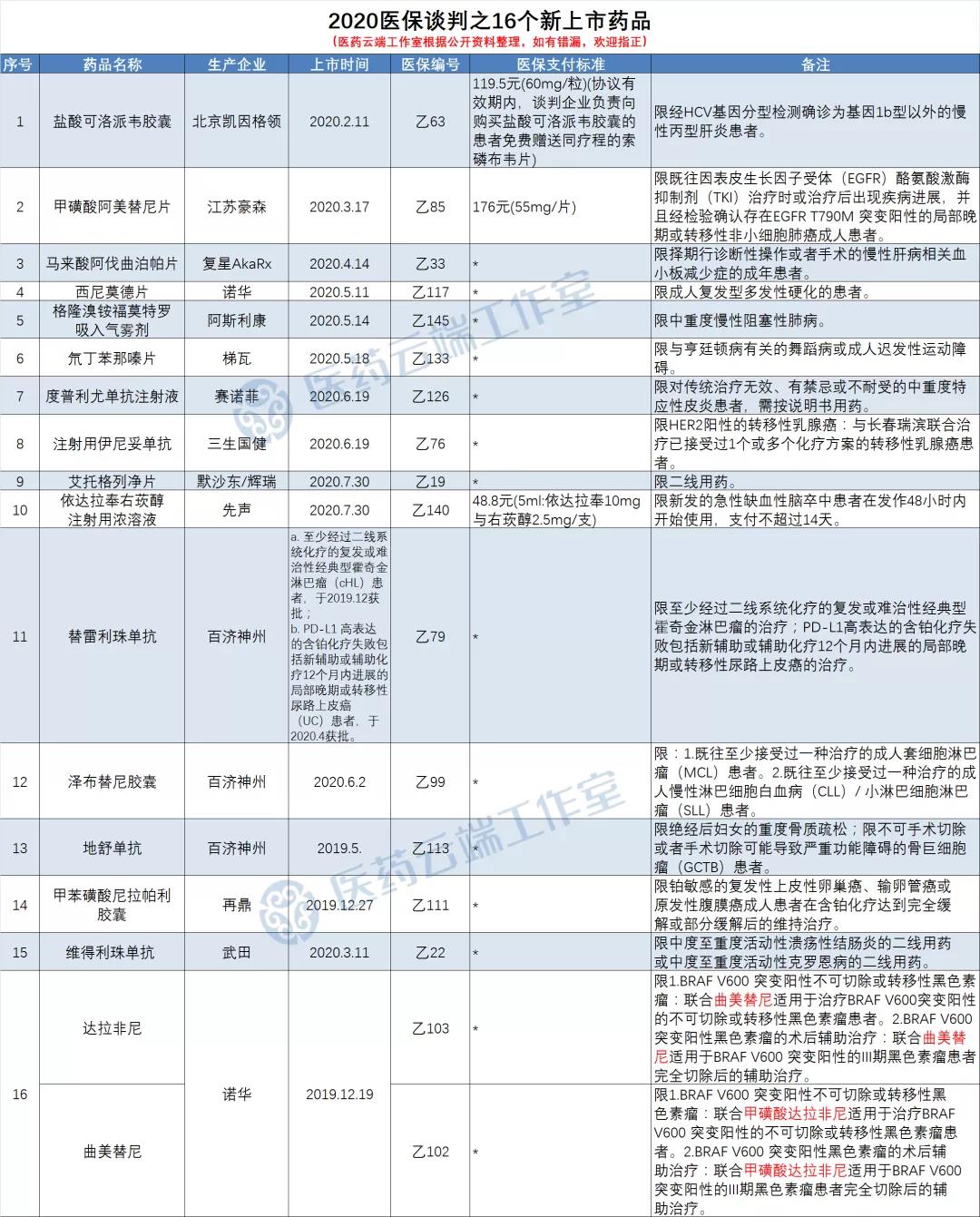
2020年4月14日,复星医药许可引进的用于择期行诊断性操作或者手术的慢性肝病(CLD)相关血小板减少症的成年患者治疗的小分子创新药马来酸阿伐曲泊帕片获批上市。
作为中国首个获得国家药监局批准、全球首个FDA批准用于CLD相关血小板减少症的口服血小板生成素受体激动剂(TPO-RA),苏可欣是与现有治疗手段相比具有明显差异化优势的创新药物,填补了治疗领域的空白,为患者带来全球领先的“强效持久、安全方便”的诊疗新选择。
格隆溴铵/福莫特罗吸入气雾剂
2020年5月,氘代丁苯那嗪片获批上市, 用于治疗罕见的常染色体显性遗传病——亨廷顿舞蹈症。
2019年12月27日,梯瓦公司在国内递交的氘代丁苯那嗪片在国内的上市申请获药审中心(CDE)承办,从被承办到获批历时不到5个月。
该药品由梯瓦公司研发,是一种囊泡单胺转运体2(VMAT2)抑制剂。2017年获FDA批准上市,商品名为AUSTEDO™,用于治疗亨廷顿舞蹈症(Huntingtons chorea),成为史上第一个上市的氘代药物。
2020年6月19日,国家药监局批准度普利尤单抗注射液(商品名:达必妥)用于治疗成人中重度特应性皮炎。该品种是我国获批治疗成人中重度特应性皮炎的靶向生物制剂,为国内临床未被满足的药品需求新增了治疗选择,同时也标志着特应性皮炎生物制剂治疗时代已经到来。
注射用伊尼妥单抗(商品名:赛普汀)
2020年6月,三生国健自主研发的注射用伊尼妥单抗(商品名:赛普汀)正式获得国家药品监督管理局批准,和化疗联用于治疗HER2阳性的转移性乳腺癌,打破了进口产品在抗HER2单抗市场的垄断局面。
艾托格列净片
2020年7月,艾托格列净片获批,成为中国获批上市的第4款钠-葡萄糖协同转运蛋白2(SGLT-2)抑制剂。该药由默沙东和辉瑞共同开发,于2017年12月获得FDA批准用于2型糖尿病,商品名为Steglatro。
依达拉奉右莰醇注射用浓溶液(先必新)
2020年7月30日,先声药业1类新药依达拉奉右莰醇注射用浓溶液(先必新)获国家药监局批准上市,是目前近5年来全球唯一获批的脑卒中新药。依达拉奉右莰醇注射用浓溶液,是由依达拉奉和右莰醇两种活性成分组成的复方制剂。
先必新以4:1的配比组合,科学配伍了两种活性成分:依达拉奉和右莰醇。III期研究结果表明,对于发病在48小时以内的急性缺血性脑卒中患者,对比单方依达拉奉注射液,依达拉奉右莰醇显示出明确的疗效优势、临床安全性相似,并大幅度将现有治疗时间窗从24小时延长至48小时,对国内脑卒中治疗来说意义重大。
甲苯磺酸尼拉帕利胶囊(则乐)
尼拉帕利是全球首个获批用于所有铂敏感复发卵巢癌患者维持治疗,而无论 BRCA 是否突变的 PARP 抑制剂,于2019年12月27日经国家药监局批准上市。
2020年9月10日,国家药监局批准则乐(尼拉帕利)的补充新药上市申请,用于晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者对一线含铂化疗达到完全缓解或部分缓解后的维持治疗;至此,尼拉帕利成为中国及全球获批的,无论患者生物标记物状态如何,均能单药用于一线和复发卵巢癌维持治疗的PARP抑制剂。
注射用维得利珠单抗(安吉优)
2020年3月,武田一款全新机制的人源化肠道选择性生物制剂安吉优®注射用维得利珠单抗获批,适应症为对传统治疗或肿瘤坏死因子α(TNFα)抑制剂应答不充分、失应答或不耐受的中重度活动性溃疡性结肠炎和克罗恩病的成年患者。
该药品是目前炎症性肠病(IBD)领域唯一的肠道选择性生物制剂,其临床数据表明能够快速起效,并实现长期持久的临床缓解和黏膜愈合,同时安全性好,是欧美国际指南推荐的一线生物制剂。
曲美替尼和达拉非尼均由GSK研发,在2015年转移给诺华。两种药物均靶向RAS-RAF-MEK-ERK信号转导通路,其中曲美替尼是首个获批上市的MEK抑制剂,达拉菲尼是一种BRAF抑制剂。
曲美替尼/达拉非尼组合最早于2013年5月在美国获批上市,目前获批的适应症包括黑素瘤、非小细胞肺癌和甲状腺未分化癌,也是FDA批准的唯一一个针对BRAF V600E突变阳性非小细胞肺癌的靶向疗法。2019年12月19日,在中国获得上市许可,适用于治疗BRAF V600突变阳性不可切除或转移性黑色素瘤。