


时间:2021-05-27 08:55 │ 来源:医药魔方 │ 阅读:1325
5月22日,基石药业在上海举办了首届肿瘤精准治疗论坛暨泰吉华®中国上市会。南京金陵医院肿瘤中心主任秦叔逵教授、北京大学肿瘤医院副院长沈琳教授、同济大学附属东方医院肿瘤医学部主任李进教授、北京大学人民医院胃肠外科主任叶颖江教授等业内权威专家出席,分享交流了胃肠道间质瘤(GIST)和肺癌等肿瘤领域的治疗现状、前沿诊疗策略及创新精准治疗解决方案等话题。
泰吉华®(阿伐替尼片)在今年3月31日获得国家药监局批准,用于治疗携带PDGFRA基因18号外显子突变(包括PDGFRA D842V突变)的不可切除性或转移性胃肠间质瘤成人患者,也是在普拉替尼之后,基石药业获批的第二款产品。
GIST是最常见的胃肠、肠系膜、网膜和腹膜间质性肿瘤,是发生于胃肠道的一种肉瘤。据估计,GIST每年全球发病率约为10万例;美国每年约有5000例新发病例;根据医药魔方流行病学数据库,国内每年约有3万例GIST新发患者。事实上,对于没有明显体征或症状的GIST通常不易被发现和诊断,因此,GIST的实际发病率可能更高。
GIST起源于胃肠道壁中的Cajal 间质细胞,是消化道间质肿瘤的最常见类型,其中大多数(82%-87%)的特征是PDGFRA和KIT中存在互斥的功能获得性突变。原发GIST中约有5%~6%的病例由最常见的PDGFRA外显子18(包括PDGFRA D842V)突变导致,约80%与原癌基因KIT突变相关[1-3]。在超过95%的GISTS中通过免疫组织化学检测到KIT(CD117)表达,使其与DOG1一起成为关键的诊断标志物,大约5%的GIST患者不表达KIT,但可能具有KIT或PDGFRA突变[4-7]。
GIST现有疗法的获益极为有限,PDGFRA D842V 突变GIST患者缺少精准的靶向治疗手段,具有高度未满足的治疗需求。伊马替尼以及早期批准的疗法治疗效果较差,中位OS为15个月,中位PFS为3个月,ORR为0%。
北京大学人民医院胃肠外科主任叶颖江教授指出:“传统治疗方案对晚期GIST患者疗效并不理想,原发耐药性突变和多线靶向治疗后的耐药进展使得GIST患者在治疗上存在着巨大的未被满足的需求。作为临床医生,我们期待越来越多的具有突破性疗效的新药进入临床应用,为更多患者带来长期生存的希望。”
阿伐替尼是一款强效、高选择性KIT/PDGFRA突变激酶抑制剂。2020年1月和9月,阿伐替尼分别被FDA和EMA批准用于治疗携带PDGFRA外显子18(包括PDGFRA D842V)突变的不可切除或转移性胃肠道间质瘤(GIST)的成年患者和治疗携带 PDGFRA D842V突变的不可切除或转移性GIST成年患者。阿伐替尼也是FDA批准的首个针对PDGFRA D842V突变的特异性激酶抑制剂,开启了GIST的精准靶向治疗时代。
GIST在50-80岁的人群中更为常见,治疗选择取决于多种因素,包括癌症的阶段和类型、副作用以及患者的健康状况和偏好等。不过,手术和靶向治疗仍是GIST的标准治疗选择,化疗、放射、栓塞术和消融术等其他疗法则较为少用。相较于FDA批准的其他GIST治疗药物,如伊马替尼、舒尼替尼和瑞戈非尼,阿伐替尼显示了对KIT/PDGFRA突变的高度选择性和活性。
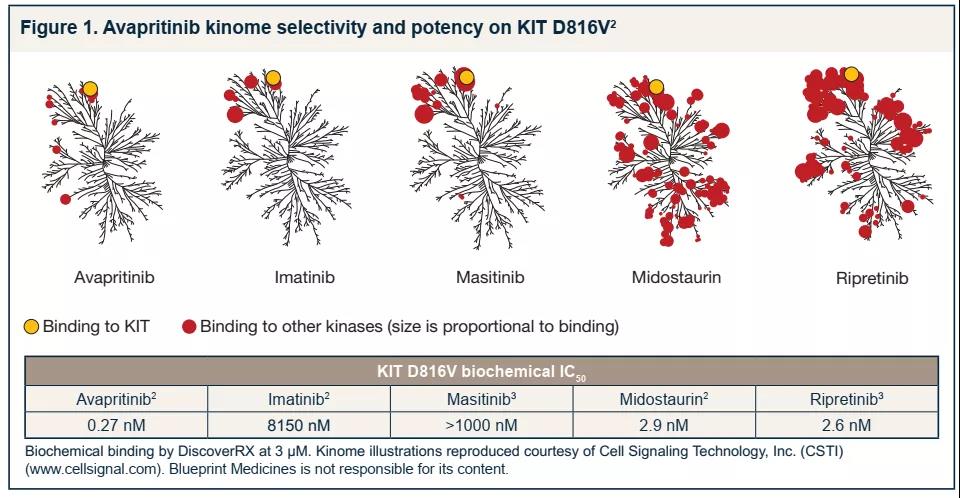

来源:ASH 2019和CTOS2018
虽然GIST患者一线靶向治疗可以接受伊马替尼,但二线及以上接受舒尼替尼或瑞戈非尼治疗时,效果较差,客观缓解率分别只有7%和5%。重要的是,临床前的研究显示,已批准的靶向药物,对于PDGFRA D842V突变没有抑制作用,这也就解释了为何对携带PDGFRA D842V突变的GIST,已批准的药物治疗效果较差。
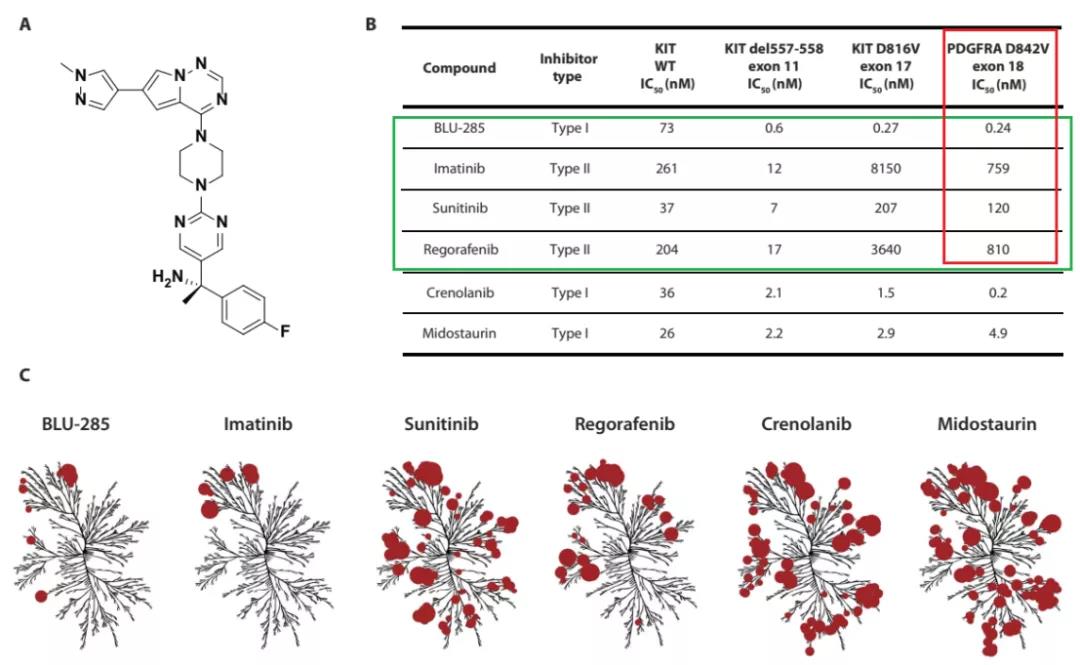
参考资料[8]
正是因为对PDGFRA D842V突变的高抑制作用所带来的疗效,阿伐替尼被FDA授予GIST突破性疗法认证(BTD),并基于一项多中心、单臂、开放的关键临床研究(NAVIGATOR)获批上市,用于治疗携带PDGFRA外显子18突变(包括D842V)的不可切除或转移性GIST。NAVIGATOR研究纳入的患者中位年龄为64岁(范围:29-90岁),男性比例为67%,ECOG PS为0-1的患者为93%,98%的患者存在转移性疾病,且86%的患者曾接受过手术切除,先前接受激酶抑制剂的中位数为1(范围:0-5)。疗效评估基于43例患者,包括38例PDGFRA D842V突变患者,PDGFRA外显子18突变患者的中位随访时间为10.6个月(范围:0.3-24.9个月)。
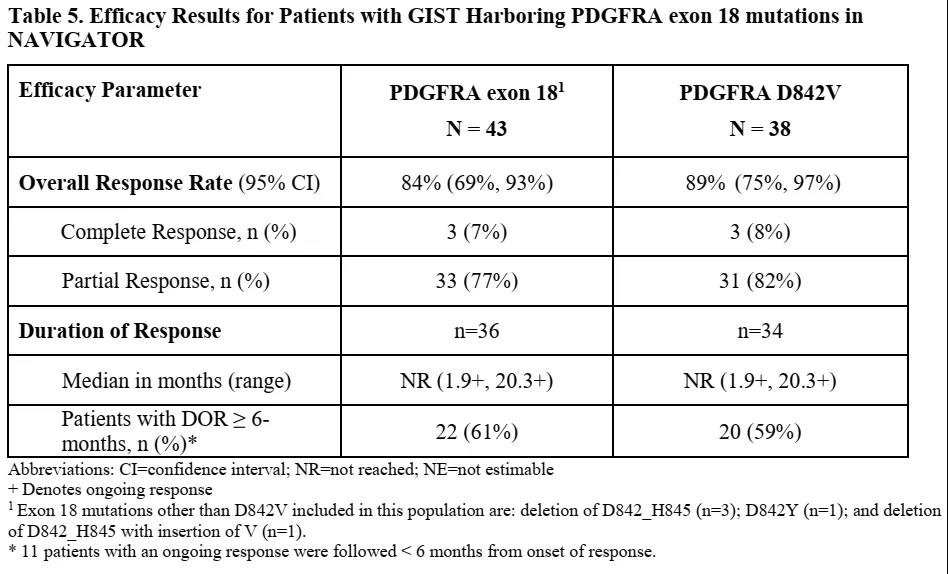
来源:FDA
可以看出,阿伐替尼在PDGFRA外显子18突变(包括D842V)的GIST患者中,显示了较高的客观反应率。在2020年9月召开的ESMO 2020会议期间,更新的NAVIGATOR研究的长期随访结果显示,阿伐替尼仍然保持较高的客观反应率,所有剂量组CR均达到10%以上,接受300/400mg的患者,中位无进展生存期(mPFS)为24个月,预测的3年总生存率为71%。
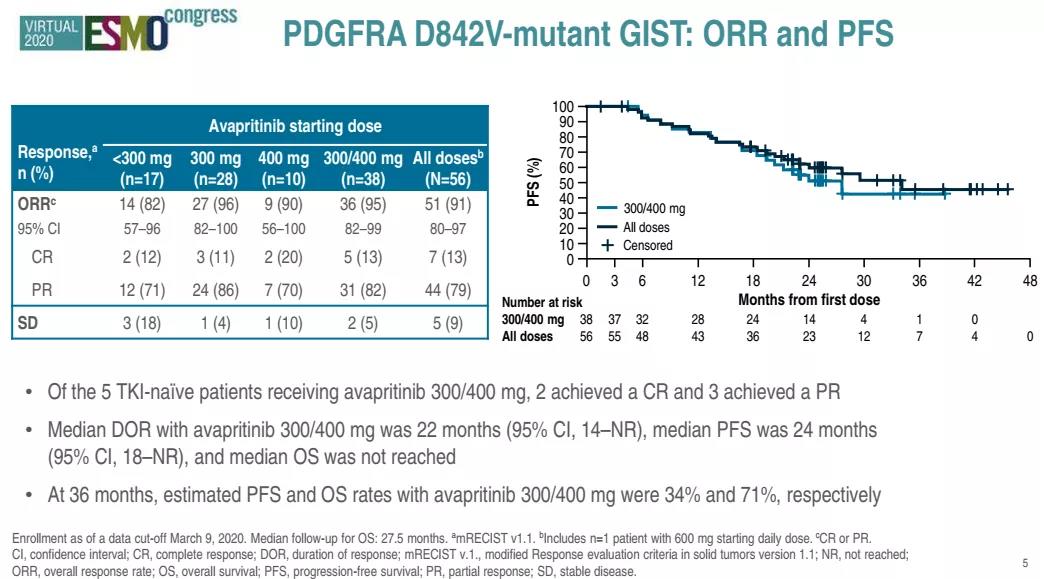
来源:ESMO2020
安全性方面,在携带PDGFRA D842V突变且接受300/400mg阿伐替尼剂量的患者中,恶心(74%)、贫血(68%)、腹泻(66%)、疲劳(58%)发生比例最高,21%的患者因与治疗相关的AE停药。

来源:ESMO2020
阿伐替尼的临床研究并非一路坦途。在3/4线治疗局部晚期不可切除/转移性胃肠道间质瘤的Ⅲ期试验头对头研究中(VOYAGER),阿伐替尼较瑞戈非尼未达到改善PFS的主要终点(mPFS:4.2 vs 5.6个月,ORR:17% vs 7%)。基于此结果,Blueprint计划停止除PDGFRA exon18突变GIST外的进一步研究。不过,2021年2月,Blueprint又公示一项阿伐替尼针对携带c-KIT/PDGFRA突变且无可用治疗方案的局部晚期或转移性恶性实体瘤(包括CNS肿瘤)的临床研究(NCT04773782);同期,研究者(M.D. Anderson Cancer Center)也发起了一项囊括肺癌、结肠癌、乳腺癌、胃食管交界处腺癌、黑色素瘤、肉瘤等多种实体瘤的探索性(II期)研究(NCT04771520)。
可以说,阿伐替尼进阶之路尚未停歇。目前阿伐替尼治疗晚期肥大细胞增生症(SM)的上市申请已经向FDA和EMA分别提交。
阿伐替尼的国内获批上市,基于一项开放、多中心的I/II期桥接临床研究,评估阿伐替尼在治疗不可切除或转移性晚期中国GIST患者的安全性、药代动力学特征和抗肿瘤疗效。受试者为既往接受伊马替尼和≥1种其他酪氨酸激酶抑制剂治疗后出现进展,或对标准治疗不耐受或携带PDGFRA D842V突变的不可切除或转移性GIST成人患者。
国内GIST现有疗法对于PDGFRA D842V 突变获益有限,GIST患者具有高度未满足的治疗需求。阿伐替尼的国内患者临床研究数据获得了与晚期GIST全球研究一致的获益:
a) 截至数据截止日期2020年3月31日,共计50例中国患者纳入阿伐替尼的安全性评估,8例携带D842V突变的患者以及23例4L+患者疗效可评估,由研究者依据实体瘤疗效评价标准1.1 版 (RECIST)进行疗效评估。截至数据截止日期,患者在200 mg和300 mg剂量下对该药均显示出了良好的耐受性,研究中未观察到剂量限制性毒性。在中国GIST患者中的II期研究推荐剂量确定为300 mg,每日一次口服。
b) 阿伐替尼在携带PDGFRA D842V 突变的患者中初步显示出了显著的抗肿瘤活性。在300 mg每日一次的剂量下,8例携带PDGFRA D842V突变的患者中,靶病灶均有缩小,5例患者达到了研究者评估的部分缓解,总体缓解率(ORR)为62.5%,另3例患者的研究者评估结果为疾病稳定。阿伐替尼在至少接受过3线既往治疗的(4L+)GIST患者中也显示出一定的疗效,研究者评估的ORR为26.1%。
c) 阿伐替尼总体耐受性良好,研究中报告的治疗相关不良事件(TRAE)大部分为 1 级或 2 级。最常见的治疗相关 TRAE 为贫血和血胆红素升高。最常报告的≥3级(均为3级)TRAE为贫血。
该研究结果同步登录ASCO 2020和CSCO 2020两大盛会,并得到国内临床专家的高度认可。阿伐替尼中国研究的主要研究者、北京大学肿瘤医院副院长沈琳教授也在此次上市会上表示:“泰吉华®是国内唯一与激酶活性构象结合的Type I 抑制剂,在PDGFRA外显子18突变的GIST患者中表现出了非常好的抗肿瘤活性,且安全性和耐受性良好。作为临床医生,我很高兴看到泰吉华®在国内上市,这为我国晚期GIST患者提供了有效的解决方案。”
基石药业首席医学官杨建新博士表示:“很高兴看到泰吉华®获批上市用于PDGFRA外显子18突变GIST患者。我们感谢所有参与泰吉华®临床研究的患者和研究者的付出和贡献,同时,也非常感谢国家药监局为泰吉华®获批而开展的优先审评审批工作,使得我们从申报新药研究申请到成功获批仅用了两年时间。基石药业成立之初即坚持聚焦肿瘤免疫和精准治疗的研发策略,此次泰吉华®的成功获批上市无疑坚定我们的决心和信心。”
为了拓展泰吉华®的临床应用,基石药业在2020年9月与北京泛生子基因科技有限公司签署合作协议,开展阿伐替尼在大中华地区伴随诊断试剂的开发及商业化,共同开发PDGFRA 外显子18 D842V突变检测试剂盒(PCR-荧光探针法),用于检测胃肠间质瘤(GIST)患者的PDGFRA基因突变。2021年3月,基石药业与国药控股股份有限公司(国药控股)签署战略合作协议,依托国药控股的进口供应链服务能力和全国分销网络以及专业的营销和服务团队,打通药品运输、营销和渠道管理,全面提升患者对基石药业产品的用药可及性。
基石药业大中华区总经理赵萍女士在本次上市会上更新了泰吉华®的商业化进展,她表示:“泰吉华®已于本月在全国30余家医院同步开出首批处方单,并正式面向全国多个省市的50多家院内和院外药房供药,从获批到实现商业可售仅用了30天。我们将进一步致力于全面提升药品的可及性和可支付性,并积极同有关政府部门展开合作,让更多的中国患者用得上、用得起好药。”