许多年以后,面对金发碧眼、高鼻梁的医生患者,新兴创新药企的海外办打工人们或许会回想起2017年中国成为国际人用药品注册技术协调会(ICH)正式会员的那个遥远的下午。
据不完全统计,2017年之后中美双报的临床获批数量较2017年前翻了近10倍。且最近两三年已有数家本土药企开始尝试国际多中心临床研究。前有泽布替尼接连拿下美国、阿联酋和加拿大的上市许可,后有信迪利单抗向FDA提交的NSCLC一线治疗的新药上市申请(BLA)正式受理,乃至中国正式成为世界卫生组织国际癌症研究机构(WHO/IARC)成员国,中国自主开发创新药的“大航海时代”序幕正在徐徐开启。如果将新药临床试验比喻成一艘满载受试者(乘客)驶向希望彼岸的大船,PI(船长)、申办方(总经理)、监管机构(指南针)、研究医生(副手)、生物统计师(设计师)、CRO(水手)们各司其职。那么,谁来担任“主帆手”,洞察研发“风向”,让中国研究者和创新药的影响力真正走向大洋彼岸?在漆黑冰冷的海面上极速航行时,又是谁来担任“瞭望员”,发现平静海面下的礁石和冰山?医药魔方Med有幸专访了从医几十载、一直在“冲浪”,屹立国内乃至国际胸部肿瘤学术科研“潮头”的广东省肺癌研究所吴一龙教授,请他分享抗肿瘤新药临床研发浪潮下的“航行日记”。弄潮搏浪的担当:高影响因子≠高影响力,
客观评价是学术“试金石”
《Journal of Clinical Oncology》(临床肿瘤学杂志,JCO)是美国临床肿瘤协会(ASCO)的官方杂志,影响因子高达32.965。3月18日,JCO在线公布了2018年间发表在该杂志上引用率最高的50篇文献。其中,共有4项中国学者参与的研究成果入选榜单,广东省肺癌研究所吴一龙教授团队入选3项,可谓独占鳌头。而这,仅仅是广东省肺癌研究所2018年以来发表IF≥20论文的惊鸿一瞥。近年,无论是全球学者库2020年8月发布的“全国肺癌专家学术影响力100强名单”,科睿唯安(Clarivate)基于web of science引用数据发布的2020年“高被引科学家”名单,爱思唯尔(Elsevier)发布的2020年“中国高被引学者榜单”,吴一龙教授在国内肺癌专家学术影响力名单中均排名第1位。面对这样的荣誉,他告诉记者:“这只是我工作的一部分,并没有很特别的地方。”医药魔方:JCO是肿瘤学最TOP的杂志之一,您作为第一或通讯作者主导的两项研究2018年以来引用量高达260次和177次。这一亮眼表现,是在意料之中吗?吴一龙:JCO这次发布的高被引榜单,从个人的角度来讲,并没有觉得有什么特别的地方。相比一两篇文章,最近几年学术界更关注的问题在于,研究者在整个从医生涯中发表的文献,在全球范围内的实际影响力。当然,一个人的学术影响力,也是由一篇一篇的文章积累而成的。JCO是国际肿瘤领域第一梯队的重要杂志,上面发表的许多文章都深刻地改变了临床实践,可以说是从侧面反映了肿瘤学科的进展。刚刚提到的两项入选研究也是如此,实实在在影响了临床实践,目前已经写入包括NCCN、ESMO、CSCO在内的各大指南。在学术界来看,一般发表杂志的影响因子越高,学术影响力越大,但两者又不能决然画等号。高影响因子是杂志本身的荣誉,但单篇文章引用量的高低谁也无法左右,这一客观评价指标相比人为评判显然是一个非常巨大的进步。需要强调的是,国际上评判一个教授或PI的时候,不仅要求作为第一作者或通讯作者的文章数量,同样重视必须有参与的研究。换句话说,永远排“老大”是不可能的,许多工作需要大家团结协作,提倡集体贡献对于学术圈发展才是有利的。
发现新大陆的眼光:实实在在的“参与”,
开天辟地的“创新”
细心的读者不难发现,此次吴一龙团队入选JCO榜单的两项研究,均是由外资大药企支持,境外新药在国内申报上市的关键临床试验(达可替尼/辉瑞;奥希替尼/AZ),可谓是外企申办方和中国专家的双赢。时过境迁,国内制药企业正以前所未有的速度发展迭代,药物研发的创新内涵也从me too 、fast follow向me better/best、first in class层层推进。然而,中国研究者主导的临床研究在创新性、试验设计规范、质量控制等方面仍与世界巨头之间存在较大差距。内资药企发起完成的临床研究,未来有没机会被进入高被引榜单?从研究者和申办方合作的角度来看,如何借助国内创新药的发展势头,让更多中国专家的影响力真正走出国门?近年来霸占学术头条的“中国好声音”、“亮相国际舞台”,从愿景转化为现实,还有几道坎?医药魔方:若想参与全球的创新药开发竞争,新时代的临床科研对研究者们提出了更高层次的要求。您作为多项国际多中心临床试验的全球leading PI,有哪些宝贵经验可以与读者分享?吴一龙:在一项国际多中心临床试验担任全球leading PI,意味着你在其中的贡献是最主要的。这个PI不是说人家做了一个工作,然后让你来挂名,不是这样的,而是从最开始的临床试验设计就要参与其中。比如二代EGFR-TKI达可替尼,当年由于毒性较大、疗效没有显著优势,美国辉瑞总部原本打算放弃。但从研究者的角度而言,达可替尼相比一代或三代TKI对EGFR的抑制更加广谱,如果在临床提早应用,抑制住可能产生耐药的通路,疗效潜力十分可佳。基于这样的合理性假设,才开展了一线头对头对比吉非替尼的ARCHER 1050研究。包括为什么ARCHER 1050研究入组排除脑转移患者,现在争议也非常大。当初的考量是,由于对照组是一代TKI,而一代TKI已经证实对脑转移的疗效不佳。如果入组脑转移患者随机分配至对照组,从伦理上是站不住脚的。这也涉及一个原则性的问题:不能为了实现研究目标,不分青红皂白损害受试者的利益。
(吴一龙朋友圈,经授权引用)
后来这个问题是如何解决的呢?研究数据显示,因脑转移导致的治疗失败,达可替尼组仅有1例,远少于吉非替尼对照组的11例。这也间接反映了达可替尼抑制脑转移的作用,与前期动物实验结论一致。如果没有深度参与临床试验设计,就完全不会考虑到上面提出的问题;也正是因为有了这些工作的贡献,最后文章发表才会以你为主;如果只是贡献几个入组病例,是永远当不了第一作者乃至通讯作者的。至于奥希替尼AURA3研究也是同样的道理。AURA3最初设计的主要终点是OS,且没有考虑后线交叉治疗的问题。入组几个病人之后,我们就发现不对,没有交叉设计的情况下观察OS,从伦理学上是不允许的。所以后来经过多方协商,把主要终点修改为PFS,并允许后线交叉治疗。总而言之,一个人会成为国际多中心研究的leading PI,并不是偶然的。不是说你在哪个中心,你的名声多大,而是要看背后是否付出了大量艰辛的工作。国内研究者要想往leading PI这个方向努力的话,首先要多参与,逐渐深度参与,而且必须要是创新性的研究,然后再来谈影响力的事情。医药魔方:您在2012年主编出版的《肺部肿瘤循证医学》一书中提到,肺癌临床研究的国际化视野充满现实困难,又有很大的发展潜力。转眼十年时间,如白驹过隙,在您看来,国内创新药的国际影响力从愿景转化为现实,还有几道坎?吴一龙:第一道坎,盲目跟风的fast-follow,原创性大打折扣。今天为止,国内肺癌临床试验看似热闹,但几乎所有药品都是follow国外成熟的靶点,只不过是fast-follow还是slow-follow的区别,归根到底还是follow。举个例子,现在国内在研的PD-1/L1单抗数量众多,已经上市8款,申请上市6款,还有14款处于3期临床阶段,更别提临床前、申报临床、1期临床的后来者。药品本身靶点follow不说,连临床试验设计都是follow的,这样的文章想要发表在高分的杂志上,非常困难。
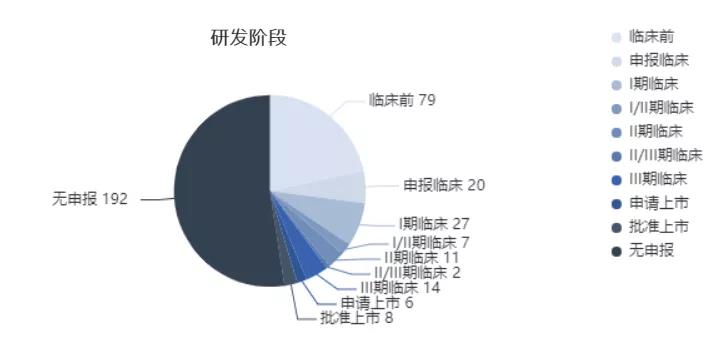
中国靶向PD-1/L1药物研发阶段分布(来源:NextPharma数据库)
所以说,内资药企要想跨出“国际化影响力”的这一大步,需要探寻真正原创性的新靶点、新作用机制。如果仍然按照目前的趋势follow下去,这个距离会拉的越来越远。第二道坎,临床试验开展地区局限于国内多中心,而非国际范围开展。国际学术圈同行评议是非常公平的,永远看重的是研究设计的原创性,看重的是新药获益能否推广到国际范围。如果不能满足以上两个条件,只能发表在第二梯队的杂志上,引用量自然而然就会降一个档次。据我所知,过去20年间,国内自主研发唯一一个发表在TOP杂志《Lancet oncology》的肺癌创新药产品就是贝达药业的埃克替尼。为什么?因为当时没有三代TKI,埃克替尼作为唯一的国产一代TKI,引用率和影响力相对就比较可观。第三道坎,申办方与研究者缺乏沟通,对治疗模式的创新性不够重视。所谓创新,并不等同于first-in-class(FIC);如果药物在某个领域的应用是超前的,或者说治疗模式是超前的,同样值得深入挖掘。比如说奥希替尼前期已经开展了大量研究,ADAURA研究还可以发表在NEJM这样的顶级期刊,就是因为我们将其用至辅助治疗,这是一个全新的领域。医药魔方:治疗模式的创新,更多来源于研究者发起研究,这与药企着重发力在注册临床试验的现状,似乎有所差异?吴一龙:没错。与注册临床试验为了适应证上市不同,研究者发起研究(IIT)旨在解决临床上有普遍意义的科学问题。中国胸部肿瘤临床研究组(CTONG)发起的绝大多数都是IIT,比如首次在脑转移患者中将一代EGFR-TKI和全脑放疗进行头对头对比,以及CTONG-1103/1104的辅助治疗、新辅助治疗,这几项研究最后都获得成功,发表在第一梯队的杂志上。这也提示我们,IIT的创新性,同样是迈向国际影响力的关键因素。与此同时,IIT需要克服的困难也会更多,一方面是资金的缺乏,另一方面需要建立强大的质量控制团队。但不管怎样,个人觉得中国研究者应该瞄准的是这一块:解决患者实际需求和临床问题。具体在选择临床问题的时候,就非常考验研究者自身的眼界、视野、以及对问题的把握度了。冰山之下的危机:“监管机构-伦理委员会-
申办方-研究者”系统的漏洞
如前文所述,国内创新药研发整体上同质化比较严重,优质的first in class项目还是极少数。这不仅限制了中国研究者走向国际影响力的步伐,从临床研究的角度来看,同质化的项目也是在消耗本就匮乏的临床试验资源。以三代EGFR-TKI为例,继奥希替尼(AZ)上市之后,阿美替尼(豪森)和伏美替尼(艾力斯)相继获批,在国内已有3款三代TKI药物的基础上,贝福替尼、瑞泽替尼等“后浪”们申请附条件上市的步伐却毫不停歇。靶向EGFR T790M药物研发阶段分布(来源:NextPharma数据库)综合考虑纳入医保后的月治疗费用,不禁令人疑惑,“后来者”的价值何在?除了肉眼可见的价格战,是否为患者提供了切实的临床价值?吴一龙认为,这是一个亟需解决的问题,同时也凸显了部分内资药企与研究者之间,包括研究者与研究者之间的分歧。医药魔方:不管是从满足临床需求的新药研发角度,还是从提升中国专家影响力的角度,您如何看待这种项目同质化的现象?吴一龙:这是一个非常好的问题。其实完全不应该出现这样的状况。国际上针对这类问题已经有了成熟的解决方案:雷同的新药临床试验方案,FDA最多批准3~4家,允许与传统的对照组进行比较,到第5家就要“叫停”或是与新建立的治疗标准比较才行。当然,成熟的药企也会考虑红海赛道的市场前景而理性决策是否继续开发。然而在中国,某个新药上市之后,追随者们往往如雨后春笋一般,扎推抢时机甚至不惜采取残酷的价格战来达到集体死亡。如果有类似的政策作为伦理委员会审评的标准,也就不会出现“蓝海变红海”的现象。一方面,市场上有太多同质化的产品竞争,老百姓真的获益吗?当价格降低到业务亏本的时候,这是好还是不好?当然,能否保障药品质量,就是另外的话题了。另一方面,如果已经写入指南作为标准治疗,比如PD-1联合化疗作为晚期NSCLC一线标准方案,这个时候依然选择单纯化疗作为对照组,是不符合伦理的做法。除了药企自身的临床试验伦理规范,这其实还涉及研究者眼光的问题。今年2月,约翰·霍普金斯大学医学院和公共卫生学院发表在BMJ的一项横断面研究引发广泛讨论——中国大量他汀临床试验浪费资源,伦理委员会缺位,涉嫌学术造假。太阳底下没有新鲜事,这与晚期NSCLC一线PD-1联合化疗对比单药化疗的临床试验现状何其相似。老实讲,从伦理角度原则上是不允许的,可能唯一的好处在于完成试验后申请上市,距离真正的创新更是十万八千里了。医药魔方:我们注意到,去年11月CDE正式发布了药品附条件批准上市技术指导原则(试行)。现在很多fast-follow新药走的就是附条件上市的道路,您怎么看?吴一龙:首先需要强调的是,附条件批准上市对于加速临床急需药品上市是非常必要的,但是仅适用于未在中国境内上市销售的中药、化学药品和生物制品。而且附条件上市意味着,上市后必须补充开展大样本量的确证性试验。实际上,正是由于近年来精准治疗的快速发展,才促成了附条件批准的可能。精准治疗有非常明确的靶点,一旦选定目标人群,有效率高、副作用低,远远优于传统治疗方案。然而硬币总是双面的,有了加速上市的通道,也就有了“钻空子”的空间,其实这样的想法都是不太对的。就在一个月前,FDA召开为期三天的肿瘤药物专家咨询委员会,专门讨论部分PD-1/PD-L1药物以“加速批准“方式上市但是在确证性临床试验中失败的适应证。来自MSD、BMS、罗氏的K药、O药、T药的六个加速获批适应证,两项遭遇撤销。丧钟为谁而鸣?这同样是给国内药企提出一个警告的信号,并非附条件上市就可以一劳永逸。结语:投资者驱动非长久之道,
申办方-研究者协作之路漫漫
提及中国肿瘤药物研发创新,有人看到繁花似锦,也有人看到满目疮痍;有人看到波涛汹涌,也有人看到暗礁四伏;有人人云亦云,也有人振臂高呼。归根到底,只有真正的“创新”才能解决问题,披荆斩棘数十载的“老船长”吴一龙向国内药企提出了三点忠告:“第一,不要盲目跟风。这么多玩家都在热门赛道上冲刺,是否应该停下来仔细想一想,是不是应该往前冲?第二,警惕投资者驱动。以临床实际需求驱动创新,才是可持续发展的多方共赢。现在很多小型药企融资后,马上就发布新闻大肆宣扬,好像早期临床进展就已经成功在望。医学报道有别于一般的大众新闻,言过其实的宣传有百害而无一利——不能看到一只蚊子,却说发现一头大象。第三,申办方和研究者之间的沟通仍需加强。限于实际经验和眼界,临床PI也无法考虑的面面俱到。科学性问题的探讨不要唯唯诺诺,药企真正优秀的首席医学官(CMO),必须要有能力跟PI争吵。”最后,请允许笔者以房龙的《宽容》序言作为结语:这样的事情发生在过去,也发生在现在,不过将来(我们希望)这样的事不再发生。









