还有不到一年时间,第三批医疗器械“身份证”将在全国落地。医疗器械出厂后,将实现流通、使用环节可追溯。伴随着医用耗材的“双码结合”,目录准入、支付管理、带量招标等也将更加智能化、透明化。
近日,天津市药监局发布《天津市药品监督管理局关于做好医疗器械唯一标识示范推广工作的通知》(以下简称《通知》)。
《通知》指出,2024年6月1日起,第三批医疗器械品种医疗器械唯一标识(以下简称“UDI”)将在全国全面实施。为进一步做好UDI全域应用和示范推广,天津市药监局组织开展了该市UDI示范单位遴选工作。遴选工作坚持先进性、示范性,综合考虑环节、实施品种、企业规模、技术先进程度等,遴选出首批16家UDI示范单位。天津正天医疗器械有限公司、天津瑞奇外科器械股份有限公司、天津市金兴达实业有限公司、天津市威曼生物材料有限公司、诺和诺德(中国)制药有限公司、赛诺医疗科学技术股份有限公司、天津市赛宁生物工程技术有限公司、臻儒(天津)科技有限公司。国药集团(天津)医疗器械有限公司、天津致新康德医疗供应链管理有限公司。天津市胸科医院、天津市肿瘤医院、天津市天津医院、天津市第一中心医院、天津医科大学总医院、天津医科大学眼科医院。《通知》指出,各示范单位要进一步拓展UDI实施应用,主动与上下游开展衔接,强化UDI全链条联动;要进一步总结经验,形成长效机制,不断提升工作水平,切实发挥引领示范作用;要积极承接UDI宣贯培训和观摩学习,进一步提升示范应用效果。各区市场监管局和各监管办要强化示范引领,积极推进辖区UDI示范工程建设,充分利用UDI实施示范单位,以点带面、以面扩域,扎实推进UDI制度有效实施。医疗器械唯一标识相当于医疗器械的“身份证”,是唯一、精准识别医疗器械的基础,贯穿医疗器械生产、流通、使用各环节,有助于医疗器械全生命周期管理。2021年1月1日起,首批9大类69个医疗器械品种实施唯一标识。2022年6月1日,其他第三类医疗器械(含体外诊断试剂)第二批实施医疗器械唯一标识。
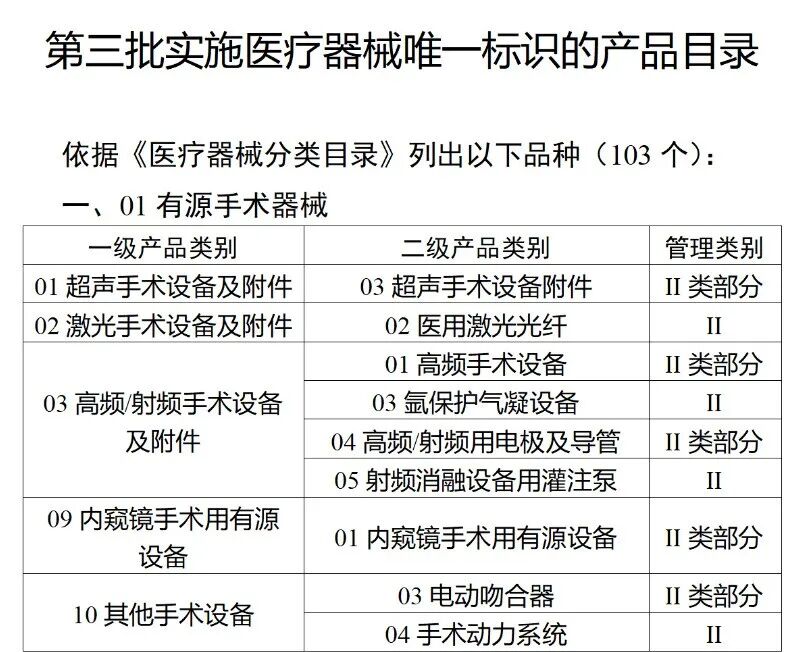
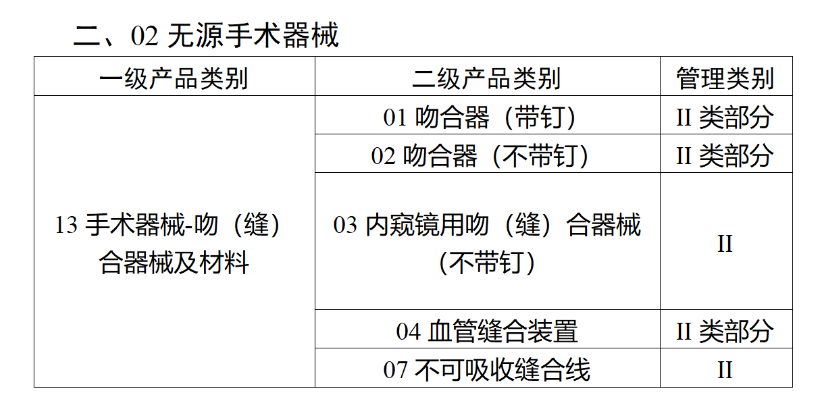
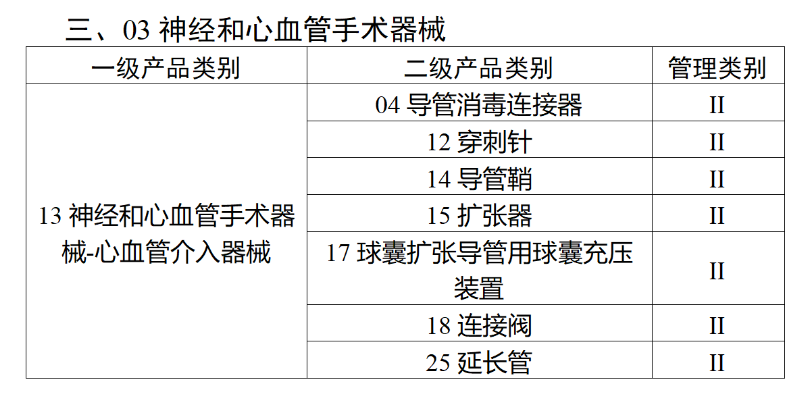
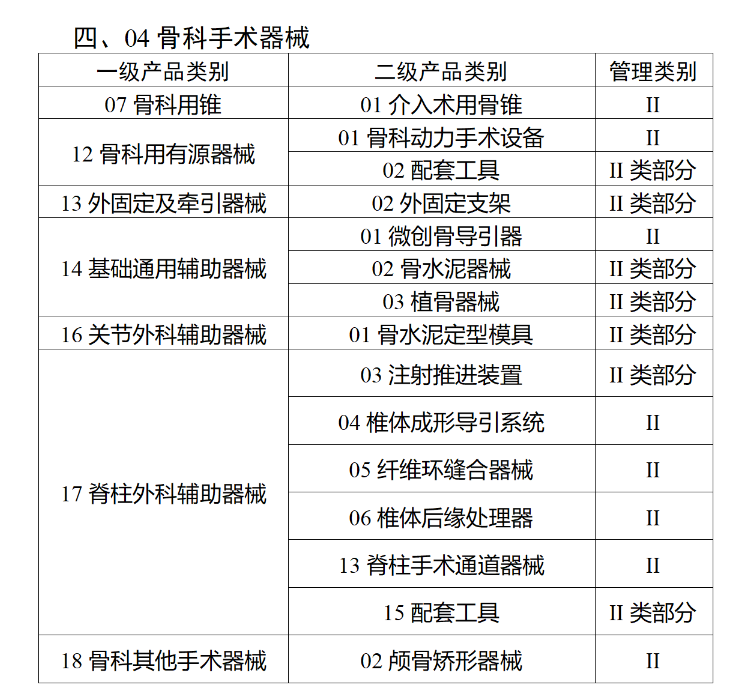
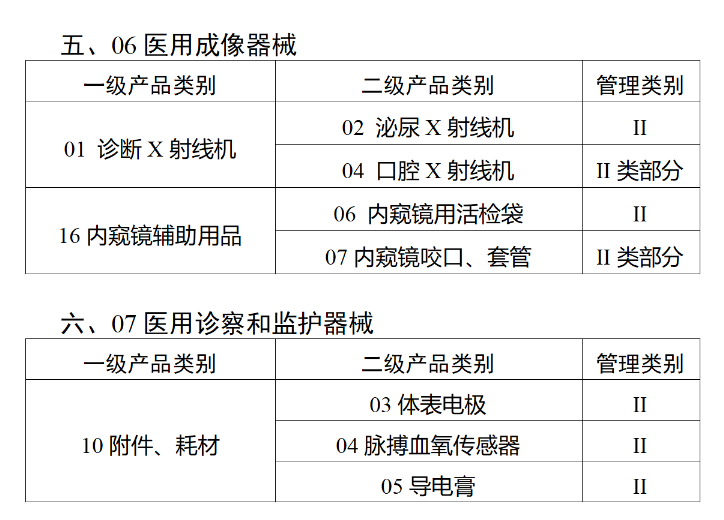
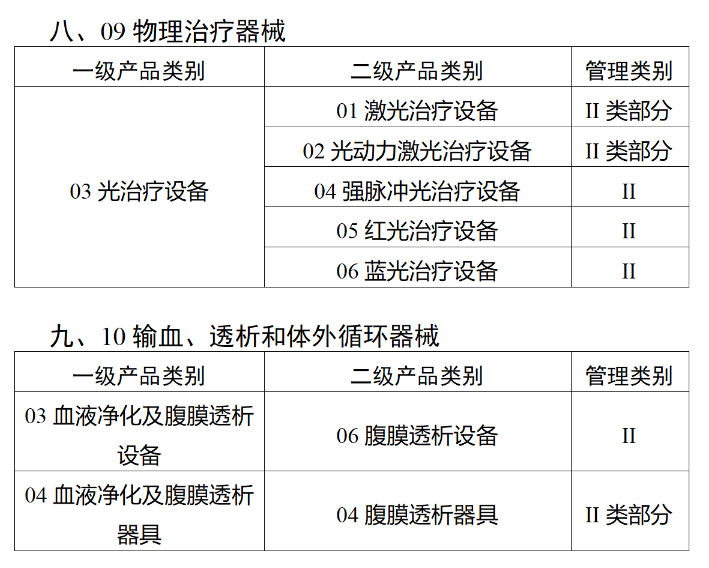
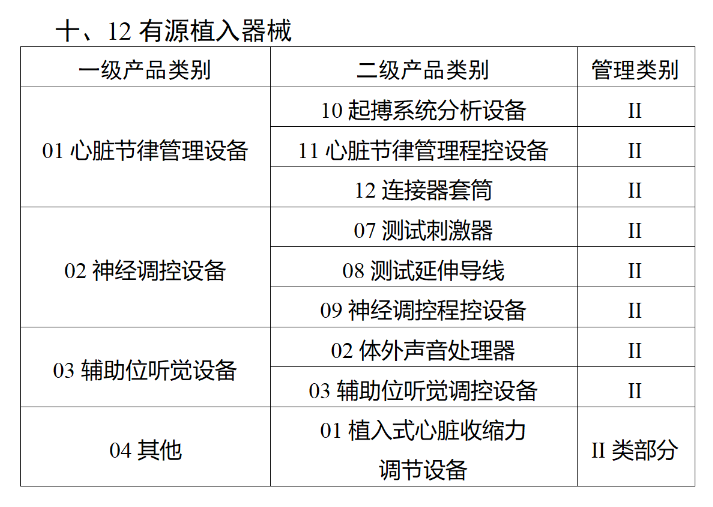
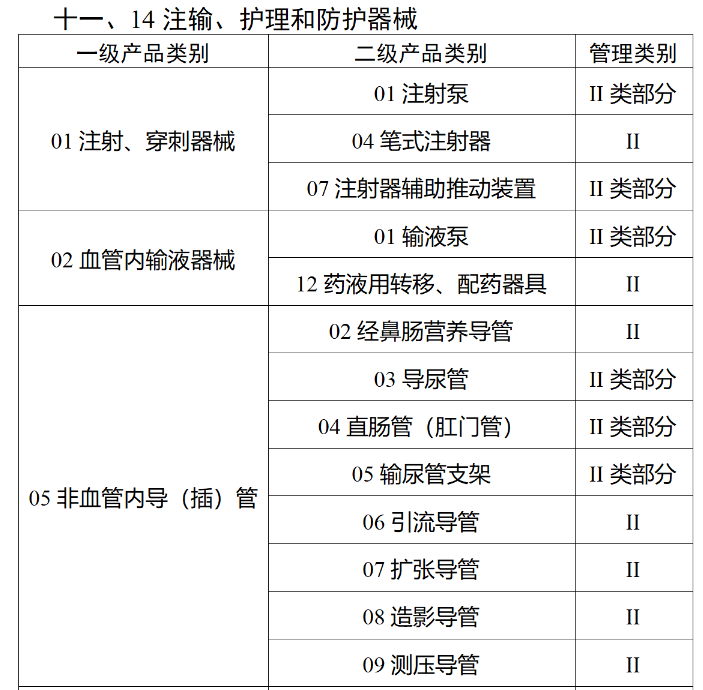
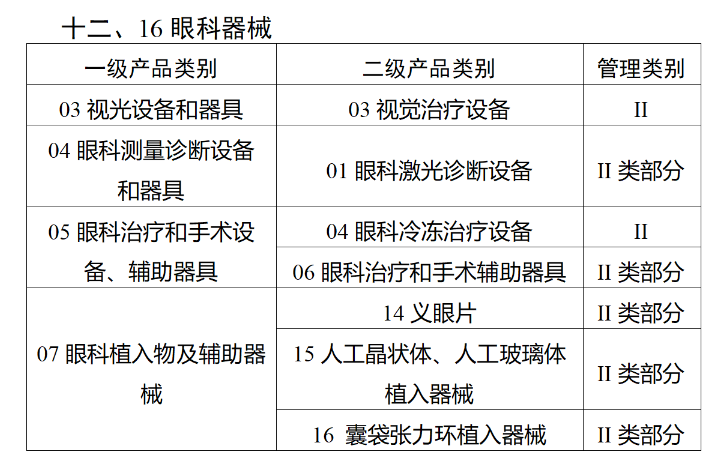
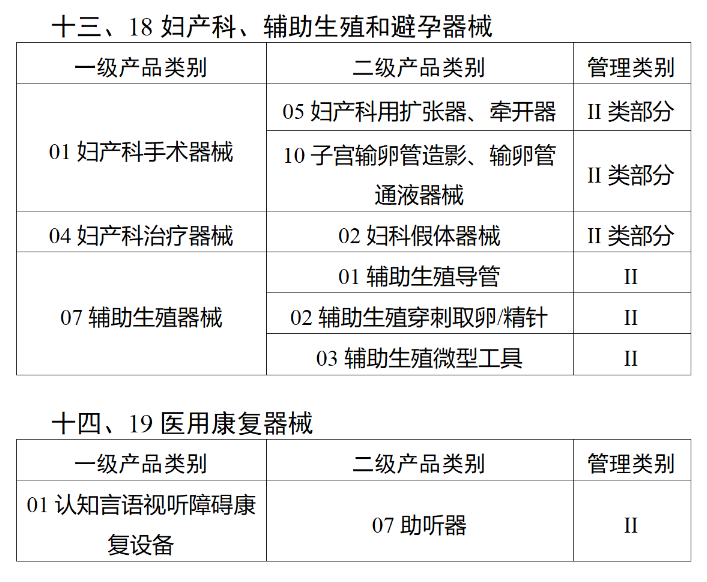
在第三类医疗器械全面落实UDI之后,二类医疗器械也将拥有“身份证”。今年2月,国家药监局、国家卫健委、国家医保局发布《关于做好第三批实施医疗器械唯一标识工作的公告》(以下简称《公告》),按照风险程度和监管需要,确定部分临床需求量较大的一次性使用产品、集中带量采购中选产品、医疗美容相关产品等部分第二类医疗器械作为第三批医疗器械唯一标识实施品种。其中包括超声手术设备附件、医用激光光纤、高频/射频用电极及导管、射频消融设备用灌注泵、内窥镜手术用有源设备、电动吻合器、血管缝合装置、不可吸收缝合线、骨水泥器械、腹膜透析设备、起搏系统分析设备、造影导管、眼科冷冻治疗设备、助听器、血细胞分析仪器等103个医疗器械品种。根据规定,2024年6月1日起生产的上述医疗器械,应当具有医疗器械唯一标识。《公告》明确,医疗器械注册人要切实落实主体责任,鼓励基于唯一标识建立健全追溯体系,做好产品召回、追踪追溯等有关工作。对于因《医疗器械分类目录》动态调整导致产品管理类别发生变化的情况,医疗器械注册人应当按照调整后管理类别的要求实施唯一标识。医疗器械经营企业要在经营活动中积极应用唯一标识,做好带码入库、出库,实现产品在流通环节可追溯。医疗机构要在临床使用、支付收费、结算报销等临床实践中积极应用唯一标识,做好全程带码记录,实现产品在临床环节可追溯。
UDI码及国家医保编码的落地,是影响医疗器械行业的两件大事。目前,两者均正在火速推广阶段,而“双码”的对接也将使得耗材多环节管理得到优化。根据前述《公告》,省级医保部门要加强医保医用耗材分类与代码与医疗器械唯一标识的关联使用,推动目录准入、支付管理、带量招标等的透明化、智能化。地方层面,药监、卫健及医保部门形成合力,推进“三医联动”。
例如,湖北省药监局加强与省卫健委和省医保局的沟通协调,积极探索医疗器械唯一标识、医用耗材编码、医院收费码的对接融合。针对骨科耗材重点品种,湖北省药监局相关部门联合行动,对该省两家骨科耗材生产企业唯一标识开展情况进行专项检查。河南省明确,要推进医疗器械唯一标识全领域覆盖应用,加强器械监管、医疗管理、医保管理等领域的衔接应用,逐步实现数据共享。 在医保环节,加强医保医用耗材编码与医疗器械唯一标识的关联使用,探索医疗器械唯一标识在医用耗材集中采购和医保结算中的应用模式。“双码”融合后,医用耗材将实现全流程闭环管理,智能监管之下,管理漏洞将被补齐。